1、填空题 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3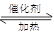 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。[91exam.org
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

参考答案:(1)3NO2+H2O=NO+2HNO3 6.72
(2)-41.8 b 8/3
(3)< 在1.3×104kPa下,CO的转化率已经很高,如果增大压强CO的转化率提高不大,而生产成本增加(3分)
本题解析:(1)二氧化氮与水反应的方程式为3NO2+H2O=NO+2HNO3;在6NO2+ 8NH3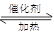 7N2+12 H2O反应中,每消耗6mol二氧化氮,转移电子24mol电子,当转移1.2 mol电子时,消耗二氧化氮0.3mol标准状况下的体积是6.72L
7N2+12 H2O反应中,每消耗6mol二氧化氮,转移电子24mol电子,当转移1.2 mol电子时,消耗二氧化氮0.3mol标准状况下的体积是6.72L
(2)根据盖斯定律得:2SO2(g)+O2(g) 2SO3(g) ΔH="-196.6" kJ·mol-1 (1)
2SO3(g) ΔH="-196.6" kJ·mol-1 (1)
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1 (2)
2NO2(g) ΔH="-113.0" kJ·mol-1 (2)
NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH可由[(1)-(2)] ÷2得到ΔH="-41.8" kJ·mol-1;
SO3(g)+NO(g)的ΔH可由[(1)-(2)] ÷2得到ΔH="-41.8" kJ·mol-1;
该反应的特点是反应前后气体体积无变化的可逆反应,a、气体的压强始终不变,不能作为平衡到达的标志,错误;b、随着反应的进行气体的颜色逐渐变浅,达平衡时,气体颜色不再变化,正确;c、SO3和NO的体积比在反应的过程中始终不变,不能作为平衡到达的标志,错误;d、对逆反应而言,每消耗1 mol SO3的同时生成1 molNO2,不能作为平衡到达的标志,错误;答案选b。
设达平衡时SO3、NO的浓度为x,则消耗NO2、SO2的浓度也为x,剩余NO2、SO2的浓度为1-x、2-x,所以(1-x)/(2-x)=1:6,解得x=0.8,所以平衡常数K=0.82/0.2×1.2=8/3
(3)由图知,随温度升高CO的平衡转化率降低,说明升高温度平衡逆向移动。正反应为放热反应,ΔH<0,
实际生产时,选择1.3×104kPa的理由是在1.3×104kPa下,CO的转化率已经很高,如果增大压强,CO的转化率提高不大,而生产成本增加
考点:考查化学方程式的书写,盖斯定律的应用,平衡状态的判断,平衡常数的计算及解决分析图像的能力
本题难度:困难
2、填空题 (10分)按要求回答下列问题:
(1)已知:
1 mol分子中的化学键断时需要吸收能量/kJ
| H2(g)
| Cl2(g)
| HCl(g)
|
436
| 243
| 431
|
则:H2(g) + Cl2(g)  2HCl(g) ΔH= kJ/mol
2HCl(g) ΔH= kJ/mol
(2)已知:乙醇的燃烧热为1411.0 kJ/mol,则乙醇燃烧的热化学方程式可表示为 。
(3)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9kJ的热量。
热化学方程式可表示为 。
(4)已知:①2CH3OH(l)+3O2(g)  2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol
2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol
②2CO(g)+O2(g)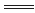 2CO2(g) ΔH2=-566.0 kJ/mol
2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)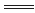 H2O(l)ΔH3=-44.0 kJ/mol
H2O(l)ΔH3=-44.0 kJ/mol
上述三个反应中,ΔS<0的是 。甲醇燃烧生成一氧化碳和液态水的热化学方程式是 。
参考答案:(1)-183kJ/mol(2分)
(2)C2H5OH(l)+3O2(g)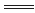 2CO2(g)+3H2O(l)ΔH=-1411kJ/mol(2分)
2CO2(g)+3H2O(l)ΔH=-1411kJ/mol(2分)
(3)H2(g)+I2(g)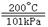 2HI(g)△H=-14.9kJ/mo(2分)
2HI(g)△H=-14.9kJ/mo(2分)
(4)②③(2分)
CH3OH(l)+O2(g)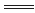 CO(g)+2H2O(l)ΔH=-442.8kJ/mol(2分)
CO(g)+2H2O(l)ΔH=-442.8kJ/mol(2分)
本题解析:(1)根据化学键键能计算反应热=436+243×2-431=-183kJ/mol(2分)
(2)燃烧热是1摩尔乙醇反应生成二氧化碳和液态水时放出的热量,热化学方程式为:C2H5OH(l)+3O2(g)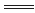 2CO2(g)+3H2O(l)ΔH=-1411kJ/mol。(3)热化学方程式注意系数代表的是物质的量,系数和反应热有对应关系,H2(g)+I2(g)
2CO2(g)+3H2O(l)ΔH=-1411kJ/mol。(3)热化学方程式注意系数代表的是物质的量,系数和反应热有对应关系,H2(g)+I2(g)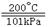 2HI(g)△H=-14.9kJ/mol。(4)ΔS<0代表的是熵变减小的,反应①时熵增的反应,反应②为熵减,反应③时熵减,所以选②③。根据盖斯定律,(反应①-反应②+反应③×4)/2,所以反应=(-1285.6+566-44*4)/2=442.8kJ,热化学方程式为:CH3OH(l)+O2(g)
2HI(g)△H=-14.9kJ/mol。(4)ΔS<0代表的是熵变减小的,反应①时熵增的反应,反应②为熵减,反应③时熵减,所以选②③。根据盖斯定律,(反应①-反应②+反应③×4)/2,所以反应=(-1285.6+566-44*4)/2=442.8kJ,热化学方程式为:CH3OH(l)+O2(g)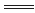 CO(g)+2H2O(l)ΔH=-442.8kJ/mol。
CO(g)+2H2O(l)ΔH=-442.8kJ/mol。
考点:化学反应进行的方向,热化学方程式的书写。
本题难度:一般
3、选择题 含1 mol Ba(OH)2的稀溶液与足量稀盐酸反应,放出热量114.6 kJ。下列热化学方程式中,正确的是
[? ]
A.Ba(OH)2( aq) +2HCl( aq) =BaCl2( aq) +2H2O(l) △H= +114.6 kJ/mol
B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l) △H= - 114.6 kJ/mol
C.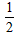 Ba(OH)2(aq) +HCl(aq)=
Ba(OH)2(aq) +HCl(aq)= BaCl2(aq) +H2O(l) △H=-57. 3 kJ/mol
BaCl2(aq) +H2O(l) △H=-57. 3 kJ/mol
D.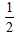 Ba(OH)2(aq) +HCl(aq)=
Ba(OH)2(aq) +HCl(aq)= 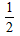 BaCl2 ( aq) + H2O(l) △H=+57.3 kJ/mol
BaCl2 ( aq) + H2O(l) △H=+57.3 kJ/mol
参考答案:BC
本题解析:
本题难度:一般
4、计算题 氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
2Fe3O4(s) 6FeO(s)+O2(g) △H=bkJ/mol (II)
6FeO(s)+O2(g) △H=bkJ/mol (II)
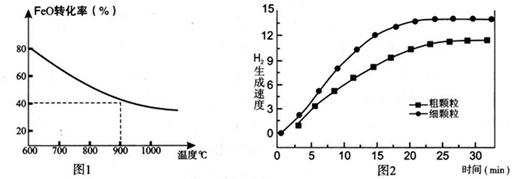
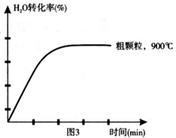
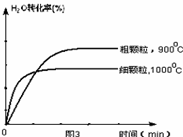
下列坐标图分别表示FeO的转化率(图-1 )和一定温度时,H2出生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图-2)。
(1)反应:2H2O(g)=2H2(g)+O2(g) △H= (用含a、b代数式表示);
(2)上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应II可采用的方案是: ;
(3)900°C时,在两个体积均为2.0L密闭容器中分别投人0.60molFeO和0.20mol H2O(g)甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计箅过程,保留两位有效数字)。
(4)在下列坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
参考答案:(16分)(1)(2a+b)kJ/mol(2分)(无kJ/mol或“2a+b kJ/mol”扣1分,其他不给分)
(2)用廉价的清洁能源供给热能(2分)(答用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能给3分;答“加热”、“升高温度”等均不给分)
(3)①细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(3分) (“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等合理表述给3分;答“增大反应物浓度”、“FeO的量增加,反应速率加快”给1分); ②相等(2分)(答“等于”、“=”给1分)
③(4分)解:900℃时,达到平衡时FeO转化的量为:n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080 (2分)
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=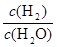 =
=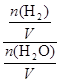 =
=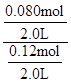 =0.67(2分)
=0.67(2分)
(4)(3分)
本题解析:(1)先对已知热化学方程式编号为①②,观察发现①×2+②可得,2H2O(g)=2H2(g)+O2(g),其焓变=①的焓变×2+②的焓变=(2a+b)kJ/mol;(2)b>0,说明反应II是吸热反应,可用用廉价的清洁能源供给热能或用“太阳能”、“风能”、“地热能”、“生物能”、“核能”供给热能;(3)①FeO是反应I中的固体反应物,细颗粒FeO表面积大,与H2的接触面积大,反应速率加快(或“增大接触面积,加快反应速率”、“接触面积越大,反应速率越快”等);②由于固体物质浓度是常数,FeO的用量和浓度保持不变,将粗颗粒FeO改为细颗粒FeO,只能加快反应速率,不能使平衡移动,因此H2O(g)的平衡转化率不变或相等;③解:900℃时,达到平衡时FeO转化的物质的量量为:n(FeO)=0.60mol×40%=0.24mol,则:
H2O(g)+3FeO(s) Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
起始物质的量(mol) 0.20 0.60 0 0
变化物质的量(mol) 0.080 0.24 0.080 0.080
平衡物质的量(mol) 0.12 0.36 0.080 0.080
由于固体物质的浓度是常数,不能写入平衡常数表达式,气体物质的浓度可以变化,根据c=n/V可求平衡时氢气和水蒸气的物质的量浓度,则K=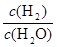 =
=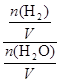 =
=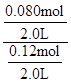 =0.67;
=0.67;
(4)观察图1可得:随着温度的升高,FeO的平衡转化率减小,前者导致平衡向吸热方向移动,后者说明平衡向逆反应方向移动,因此逆反应是吸热反应,则反应I的正反应是放热反应;其他条件保持不变时,900℃→1000℃就是升高温度,既能加快反应速率,又能使平衡向逆反应方向移动,则H2O(g)的转化率由0逐渐增大,知道达到平衡,1000℃时达到平衡的时间比900℃时少,1000℃时H2O(g)的平衡转化率比900℃时小,由此可以画出水蒸气的转化率随温度变化的示意图。
考点:考查化学反应原理,涉及盖斯定律、常见的能量转化形式、固体反应物颗粒粗细对反应速率和平衡移动的影响、化学平衡常数的计算、温度对反应速率和平衡移动的影响图像等。
本题难度:困难
5、填空题 中国气象局的数据显示,2013年全国平均雾霾天数为52年来之最。形成雾霾的主要成份为:生产生活中排放的废气、汽车尾气及扬尘等。
(1)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ/mol
2NO2(g)=N2O4(g) △H=-56.9 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 。
(2)已知:CO(g)+H2O(g)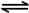 CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)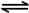 CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
CO(g)+H2O(g)的化学平衡常数为 。相同条件下,向同一密闭容器中充入1.0molCO2和1.0molH2反应达到平衡后,吸收的热量为 kJ。
(3)碱式硫酸铝法烟气脱硫工艺主要有以下三步
①向Al2(SO4)3溶液中投入粉末状石灰石,生成碱式硫酸铝[Al2(SO4)3·Al2O3]溶液。
②碱式硫酸铝吸收SO2,Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3,请写出Al2(SO4)3·Al2O3与过量烧碱溶液反应的化学方程式 。
③将Al2(SO4)3·Al2 (SO3)3氧化成Al2(SO4)3,可选用氧化剂为 (填代号)
A.浓硫酸
B.KMnO4溶液
C.5%的H2O2溶液
D.空气