1、选择题 下列各组混合气体分别通入水中,其中一种气体消失,另一种气体体积增大的是(双选)( )
A.HCl、CO2
B.O2、F2
C.NO、NO2
D.H2S、SO2
参考答案:BC
本题解析:
本题难度:一般
2、选择题 在通常情况下,NO2的颜色是
[? ]
A.黄绿色
B.红棕色
C.蓝色
D.无色
参考答案:B
本题解析:
本题难度:简单
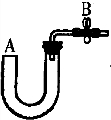
3、简答题 (1)右图所示是实验室中制取气体的一种简易装置
.
①请简述检验它的气密性的方法______.
②利用右图所示装置可以制取______气体(填反应物状况及发生反应是否需要的条件).
(2)张明同学设计下图所示装置,用粗铁粒与189g?L-1硝酸反应制取NO气体.请回答有关问题.
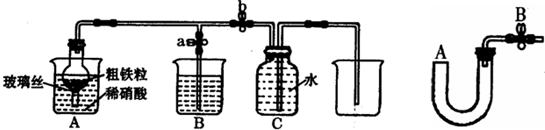
①189g?L-1硝酸的物质的量浓度为______.
②NO气体能用排水法收集,而不能用排空气法收集的可能原因是______.
③当打开止水夹a,关闭止水夹b时,A装置的干燥管中观察到的现象是______.B装置烧杯中液体的作用是______.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
④该实验中,若去掉B装置,对实验结果是否有影响?______.
⑤将a?mol铁与含b?molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反应后Fe和HNO3均无剩余,则反应中转移电子的物质的量是______(用含a或b的代数式表示).w⑥完全反应后,A装置烧杯里含铁的价态可能是______.现有仪器和药品:试管和胶头滴管.0.1mol?L-1KSCN溶液、0.1mol?L-1KI溶液、0.2mol?L-1酸性KMnO4溶液、氯水等.请你设计一个简单实验,探究上述判断,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论
第一步
取少量液体装于试管,向试管中滴入几滴KSCN溶液
第二步
若溶液紫色退去,则说明含有Fe2+,
若无明显变化,则说明不含Fe2+
参考答案:(1))①装置的气密性关键在于塞子和试管之间接触是否严紧,检查的办法是:关闭止水夹B,从A处加入水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好,故答案为:关闭止水夹B,从A处加入水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好;
②根据装置来确定可以制取的气体,该装置可以制取块状或较大颗粒状固体与液体不需要加热反应生成的气体,故答案为:块状或较大颗粒状固体与液体不需要加热反应生成的;
(2)①硝酸的物质的量浓度c=nV=mMV=189g63g/mol1L=3mol?L-1,故答案为:3mol?L-1;
②一氧化氮的性质:极易和空气中的O2反应,与空气密度接近,所以不能用排空气法,故答案为:NO与空气中的O2反应,NO与空气密度接近;
③铁和稀硝酸反应生成一氧化氮,一氧化氮会迅速被氧化为二氧化氮,所以A装置的干燥管中观察到的现象是:有红棕色气体出现,二氧化氮有毒,属于酸性气体,可以用烧碱溶液吸收,故答案为:有红棕色气体出现;吸收NO2;
④二氧化氮和水反应产物是一氧化氮,所以若去掉B装置,对收集一氧化氮不后悔产生影响,故答案为:无影响;
⑤氧化还原反应中得失电子数目相等,Fe和HNO3均无剩余,金属铁全转化为亚铁,铁失电子的量为2amol,金属铁全转化为三价铁,铁失电子的量为3amol,金属铁的生成物既有亚铁离子又有三价铁离子是,铁失电子的量就2a~3amol之间,硝酸显示酸性和氧化性,显示酸性的硝酸和表现氧化性的硝酸的物质的量之比均为3:1,此时硝酸的电子的量为3b4mol,故答案为:3b4mol(2amol或3amol或2amol~3amol);
⑥铁相对于硝酸过量时,产物只有亚铁离子,亚铁离子具有还原性,能使高锰酸钾褪色,弱硝酸相对于硝酸不足时,产物只有三价铁离子,三价铁遇KSCN溶液显红色,有可能铁的两种价态均存在,故答案为:实验步骤操作现象与结论第一步取少量液体装于试管,向试管中滴入几滴KSCN溶液若溶液变血红色,说明含Fe3+,若溶液无明显变化,说明不含Fe3+第二步取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液若溶液紫色退去,则说明含有Fe2+,
若无明显变化,则说明不含Fe2+.
本题解析:
本题难度:一般
4、简答题 请回答下列实验室中制取气体的有关问题.
(1)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
①装置B,C的作用分别是:B______C______.
②写出该反应的离子方程式为______.
③若实验室欲制取5瓶容积为100mL的氯气(室温下,氯气的密度为2.90g/L),理论需要KMnO4固体的质量为______g(保留2位小数,浓盐酸过量),反应中发生转移的电子的物质的量为______mol(保留2位小数).
(2)在实验室欲制取适量NO气体.
①如图(Ⅰ~Ⅳ)中最适合完成该实验的简易装置是______(填序号).
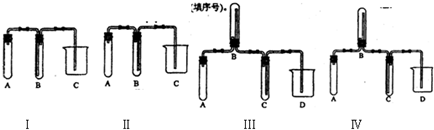
②根据所选的装置完成列表(不需要的可不填).
应加入的物质
所起的作用
A
______
______
B
______
______
C
______
______
D
______
______
|
③简单描述应观察到的实验现象:______.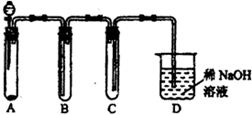
参考答案:(1)①生成的氯气密度比水大,可用向上排空气法收集,则B为收集装置,C为防止倒吸的装置,可起到防止D中的液体倒吸进入集气管B中,
故答案为:向上排气法收集氯气;安全作用,防止D中的液体倒吸进入集气管B中;
②实验室用高锰酸钾和浓盐酸反应制备氯气,发生:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
③制取5瓶容积为100mL的氯气,质量为5×100×10-3L×2.90g/L=1.45g,n(Cl2)=1.45g71g/mol,则m(KMnO4)=1.45g71g/mol×25×158g/mol=1.29g,反应中发生转移的电子的物质的量为1.45g71g/mol×2=0.04mol,
故答案为:1.29;0.04;
(2)①NO易与空气中氧气反应,则应用排水法收集,收集时进气管较短,则应选择Ⅱ装置,故答案为:Ⅱ;
②Ⅱ装置中A加入稀硝酸和铜,为气体发生装置,B为气体的收集装置,用排水法收集,C为接受B中排出的水的装置,
故答案为:应加入的物质所起的作用A铜屑和稀硝酸产生NO气体B水排水收集NO气体C接收B中排出的水D③稀硝酸与铜反应生成无色的NO气体,可观察到有无色小气泡生成,反应放热,反应速率逐渐加快,NO与空气中的氧气反应生成红棕色的二氧化氮气体,与水反应生成无色的NO,生成硝酸铜为蓝色,可观察到A中的液体逐渐变为蓝色,气体NO不溶于水,可将B中的水排到C中,
故答案为:反应开始时,A中铜表面出现无色小气泡,反应速率逐渐加快:A管上部空间由无色逐渐变为浅红棕色,随反应的进行又逐渐变为无色;A中的液体由无色变为浅蓝色;B中的水面逐渐下降,B管中的水逐渐流入烧杯C中.
本题解析:
本题难度:一般
5、简答题 依据如图1所示氮元素及其化合物的转化关系,请回答:
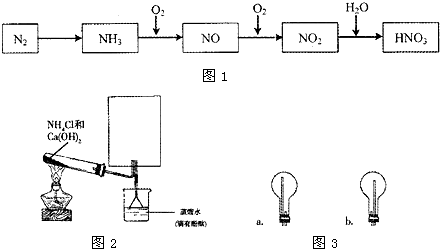
(1)实验室常用右图装置制取并收集氨气.试管中反应的化学方程式是______.
(2)如图2所示方框内收集氨气的仪器装置是图3中的______(填字母).
(3)用NH3制取NO的化学方程式是______.
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理.完成相应的化学方程式:
2NO2+Na2CO3═NaNO2+______+______.
参考答案:(1)实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,
反应的化学方程式为2NH4Cl+Ca(OH)2△.2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2△.2NH3↑+2H2O+CaCl2;
(2)氨气密度比空气小,应用向下排空法收集,故答案为:a;
(3)氨气在催化剂条件下与氧气反应生成一氧化氮和水,为重要的工业反应,反应的化学方程式4NH3+5O2催化剂.△4NO+6H2O,
故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(4)二氧化氮在碳酸钠溶液中自身发生氧化还原反应生成硝酸钠、亚硝酸钠和二氧化碳气体,反应的化学方程式为2NO2+Na2CO3═NaNO2+NaNO3+CO2,
故答案为:NaNO3;CO2.
本题解析:
本题难度:简单