1、选择题 有一充有20mL NO2和O2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有10mL无色气体,则原混合气体中NO2与O2体积比为(气体体积均在相同状况下测得)( )
A.2:3
B.3:2
C.3:1
D.2:5
参考答案:A
本题解析:
本题难度:简单
2、选择题 大量汽车尾气也会引起酸雨.下列汽车尾气中能引起酸雨的是( ? )
A.N2
B.CO
C.NO2
D.CO2
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知:2NO2(g)
2NO(g)+O2(g)△H<0,下列关于该反应的示意图或描述不正确的是( )
A.
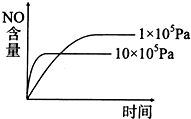
B.
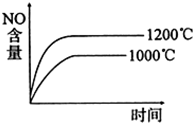
C.NO难溶于水,可以用排水法收集
D.当生成标准状况下3.36L的氧气时,该反应转移0.6mole-
参考答案:B
本题解析:
本题难度:简单
4、简答题 为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
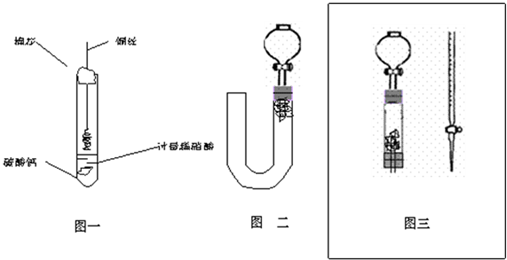
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:______.
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会______而使后面的实验无法观察到预期现象.
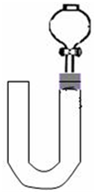
②反应开始后,因为随着NO的体积增加,______影响铜丝与硝酸的继续反应.
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达______,设定有条件精确称量,还需要的数据是______.
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
参考答案:(1)一氧化氮不稳定,能和空气中的氧气 反应生成红棕色的二氧化氮,产生杂质干扰实验,装置中有空气,用碳酸钙固体和硝酸反应生成二氧化碳排出空气,且二氧化碳和一氧化氮不反应,故答案为:除去装置内的空气,防止生成的NO被氧化而影响实验效果;
(2)①装置内部有空气,可能将一氧化氮氧化,故答案为:因如图所示的铜丝所在空间中被封闭一段空气;
②产生的NO排开酸液而与铜丝脱离接触,故答案为:产生的NO排开酸液而与大部分铜丝脱离接触;
(3)可在左边加一个漏斗,增大所盛液体的体积,装置如图:

,故答案为:

;
(4)注入的硝酸在滴定管中至少应到达分液漏斗最大量程刻度处;根据反应的铜丝的质量可以求出NO的理论产量,然后根据产率的公式计算产率,故答案为:分液漏斗最大量程刻度处;铜丝反应前后的质量;
(5)可能发生的反应方程式:2NO2+H2O=HNO2+HNO3;NO2+NO+H2O=2HNO2;4NO+O2+2H2O=4HNO2在此反应条件下,氮氧化物(NO、NO2)的最终产物并非HNO3一种,实际存在着较低价态的HNO2,实际消耗氧气的量将要减少,故答案为:2NO2+H2O=HNO2+HNO3 ;NO2+NO+H2O=2HNO2;4NO+O2+2H2O=4HNO2 在此反应条件下,氮氧化物(NO、NO2)的最终产物并非HNO3一种,实际存在着较低价态的HNO2,实际消耗氧气的量将要减少.
本题解析:
本题难度:一般
5、选择题 在通常情况下,NO2的颜色是
[? ]
A.黄绿色
B.红棕色
C.蓝色
D.无色
参考答案:B
本题解析:
本题难度:简单