1、选择题 把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
A.反应后生成的盐只为Fe(NO3)3
B.反应后生成的盐只为Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
参考答案:C
本题解析:22.4g铁粉的物质的量为0.4mol;收集到0.3 mol NO2和0.2 mol NO过程中转移的电子数为: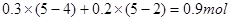 ,所以可得22.4g铁粉反应后生成了硝酸铁和硝酸亚铁,由得失电子数相等可得Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
,所以可得22.4g铁粉反应后生成了硝酸铁和硝酸亚铁,由得失电子数相等可得Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
本题难度:一般
2、计算题 钢铁生锈的过程十分复杂,已知某铁锈含有Fe2O3?nH2O(n≤1),还可能有Fe(OH)3和F eCO3。某学习小组做了以下实验:
eCO3。某学习小组做了以下实验:
①取12.574g铁锈隔绝空气加热至恒重,得到固体10.528g。
②另取6.287g铁锈,在205.00 mL 1.000mol/L的稀硝酸中恰好完全溶解,产生NO气体89.60 mL(标准状况)。
(1)根据实验①,铁锈中是否只含Fe2O3?nH2O?试通过计算回答。
(2)根据实验②,能否确定铁锈中含有FeCO3 ?理由是什么?
?理由是什么?
(3)若n=0.8,试通过计算确定6.287g铁锈的成分以及它们的物质的量。
参考答案:(共6分)
(1)否;若只含Fe2O3?nH2O,则Fe2O3与H2O的物质的量之比为
10.528÷160/(12.574-10.528)÷18=0.0658:0.114=1:1.72? n>1,不合题意(2分,合理即可)?(2)有,因为只有FeCO3显还原性(1分,合理即可)
(3)Fe2O3?0.8H2O:0.025 mol;Fe(OH)3:0.005 mol;FeCO3:0.012mol(各1分)
本题解析:略
本题难度:一般
3、填空题 (4分)用下面方法可以制得白色的Fe(OH)2沉淀 用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入?;
(2)除去蒸馏水中溶解的氧 气常采用?的方法;
气常采用?的方法;
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是?。
参考答案:(1)铁粉?(2)煮沸?(3)防止与空气中的氧气接触
本题解析:略
本题难度:一般
4、选择题 下列各组物质不能按所示关系实现转化的是表示反应一步完成( )
A.
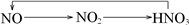
B.

C.
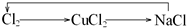
D.
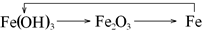
参考答案:D
本题解析:
本题难度:一般
5、填空题 (9分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列各题。
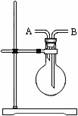
(1)所含铁元素既有氧化性又有还原性的物质是(?)(用字母代号填)。
A.Fe
B.FeCl3
C.FeSO4
D.Fe2O3