1、选择题 下列离子方程式中,正确的
A.在AlCl3溶液中加入过量氨水:Al3+ + 3NH3·H2O =Al(OH)3↓ + 3NH4+
B.大理石加入过量盐酸中:CO32-+2H+= CO2↑+H2O
C.稀硫酸和Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.在CuSO4溶液中加入Ba(OH)2溶液:Ba2+ + SO42- =BaSO4↓
参考答案:A
本题解析:A、氨水是弱碱,不溶解氢氧化铝,A正确;B、大理石是难溶性物质,应该用化学式表示,B不正确;C、不符合定比组成,应该是Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,C不正确;D、反应中还有氢氧化铜蓝色沉淀生成,D不正确,答案选A。氯化银是难溶性物质,应该有化学式表示,A不正确;B正确,C中氢氧化钠不足,氢氧化钠首先和氢离子反应,C不正确;D中电荷不守恒,不正确,答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
2、选择题 下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3
2H++ SO3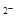
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+
NH3·H2O + H+
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3
CO3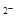 +H3O+
+H3O+
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+
+3NH3·H2O= Al(OH)3↓+3NH4+
参考答案:BD
本题解析:A、亚硫酸是弱电解质,是分步电离的,往往以第一步为主,错误;B、正确;C、不是水解的方程式,应该为:HCO3-+H2O? H2CO3+OH-,错误;D、正确。
H2CO3+OH-,错误;D、正确。
本题难度:一般
3、选择题 下列离子方程式正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.Ca(HCO3)2+与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.NaCO3溶液中通入过量CO2:CO32-+CO2+H2O=2HCO3-
D.CH3COOH溶液与NaOH溶液反应:H++OH-=H2O
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列离子方程式正确的是
A.稀硫酸滴在铜片上: Cu + 2H+ ="=" Cu2+ + H2↑
B.氧化镁与盐酸混合: MgO+ 2H+ ="=" Mg2+ + 2H2O
C.铜片插入硝酸银溶液中: Cu + Ag+ ="=" Cu2+ + Ag
D.大理石溶于醋酸的反应: CO32- + 2CH3COOH ==2CH3COO- +CO2↑+ H2O
参考答案:B
本题解析:A错,铜与稀硫酸不反应;B正确;C错,正确为: Cu + 2Ag+ ="=" Cu2+ + 2Ag;D错,碳酸钙为难溶于水的物质,不能拆成离子形式;
本题难度:一般
5、简答题 某核素ZAX的氯化物XCl21.10g配成溶液后,需用1mol?L-1的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数;
(2)若X的核内中子数为20,求37g?X1735Cl2中所含质子的物质的量.
参考答案:(1)硝酸银的物质的量为0.02L×1mol?L-1=0.02mol,即银离子的物质的量为0.02mol,
由Cl-+Ag+═AgCl↓可知,硝酸银溶液20mL能把氯离子完全沉淀下来,
则Cl-的物质的量为0.02mol,
XCl2的物质的量为0.01mol,
则XCl2的摩尔质量为1.10g0.01mol=110g/mol,
其相对分子质量为110,则X的质量数为110-35×2=40,
答:X的质量数为40;?
(2)X的质子数为40-20=20,Cl的质子数为17,
37g?X1735Cl2中所含质子的物质的量为37g110g/mol×(20+17×2)=18mol,
答:37g?X1735Cl2中所含质子的物质的量为18mol.
本题解析:
本题难度:一般