1、填空题 A、B、C、D、E、F、G七种物质间存在如图所示的转化关系,其中A、B、D、G含有同种元素。
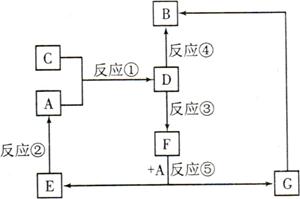
已知:
A为金属单质,B为红褐色固体,E为密度最小的气体,G为浅绿色的溶液。
D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。
在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物。
请回答下列问题:
(1)构成C物质的元素在周期表中的位置是?,在短周期主族元素中,该元素与其相邻元素的原子半径从大到小的顺序是?(用元素符号表示)。
(2)D的水溶液呈?性,请用离子方程式解释原因:?。
(3)上述反应中属于置换反应的是?(填序号)。
(4)反应③(即D将某种氧化物氧化为F)的离子方程式:?。
(5)对气体C进行如下实验。已知整个反应过程中,每消耗0.1mol KI,转移的电子数约为3.612×1023个。请按照要求填空:
实验步骤
| 实验现象
| 写离子方程式
|
将少量气体通入淀粉KI溶液
| 溶液最初变成?色
| ?
|
继续通入气体
| 溶液逐渐变成无色
| ?
|
?
参考答案:(1)第三周期 第Ⅶ A族 ; S > Cl > F?各1分共2分
(2)酸? Fe3++3H2O?Fe(OH)3+3H+?各1分共2分
(3)②⑤? 2分(答对1个给1分,见错就不得分)
(4)2Fe3++SO2+2H2O =?2Fe2++SO42- +4H+?…… 2分
(5)蓝(1分)?Cl2+2I-=?I2+2Cl-?(1分)? 5Cl2+I2+6H2O =? 12H++2IO3-+10Cl-? 2分
本题解析:由题意知,B为红褐色固体,B为Fe(OH)3, E为密度最小的气体,E为H2,G为浅绿色的溶液,则G为Fe2+溶液,D的水溶液为黄色溶液,能与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀。则D为FeCl3,由反应①推知A为Fe,C为Cl2
(1)构成C物质的元素氯在元素周期表中的位置是第三周期 第Ⅶ A族 ;根据原子半径的大小决定因素可知,该元素与其相邻元素S、F的原子半径的大小关系是S > Cl > F
(2)FeCl3溶液显酸性,是因为Fe3+水解的缘故,水解的离子方程式为Fe3++3H2O?Fe(OH)3+3H+
(3)反应②中由H2置换Fe,反应⑤中F为化合物,A为单质Fe,产物中E为H2,G为亚铁盐,均符合置换反应的概念,所以属于置换反应的是②⑤
(4)在水溶液中D能将某氧化物氧化为F,F是含有三种元素的化合物,根据常识可知F为硫酸,反应③的离子方程式为2Fe3++SO2+2H2O =?2Fe2++SO42- +4H+
(5)氯气置换出碘单质,碘与淀粉变蓝色,所以溶液最初变蓝色,对应的离子方程式为Cl2+2I-=?I2+2Cl-,继续通氯气,溶液变无色,说明氯气把碘单质氧化成了碘酸,对应的离子方程式为
5Cl2+I2+6H2O =? 12H++2IO3-+10Cl-
本题难度:一般
2、选择题 下列反应的离子方程式正确的是
A.碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3·H2O
B.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.1 mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积互相均匀混合:
2AlO2-+5H+= Al(OH)3↓+Al3++H2O
D.向硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
参考答案:D
本题解析:略
本题难度:简单
3、选择题 下表中评价合理的是( )
| 选项 | ?化学反应及其离子方程式 | ?评价
A
Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O
?正确
B
向碳酸镁中加入稀盐酸:CO32-+2H+═CO2+H2O
错误,碳酸镁不应该写成离子形式
C
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓
?正确
D
FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2
错误,Fe2+与Br-的化学计量数之比应为1:2
|
A.A正确
B.B正确
C.C正确
D.D正确
参考答案:A、Fe3O4与稀硝酸反应产生的气体是一氧化氮,不会产生氢气,故A错误;
B、碳酸镁是难溶物质,不应该写成离子形式,故B正确;
C、铵根离子能和氢氧根离子反应产生氨气或者是一水合氨,向硫酸铵溶液中加入氢氧化钡溶液,反应为:2NH4++Ba2++SO42-+2OH-═BaSO4↓+2NH3?H2O,故C错误;
D、亚铁离子的还原性强于溴离子,FeBr2溶液与等物质的量的Cl2反应为:2Fe2++3Cl2+4Br-═2Fe3++6Cl-+2Br2,故D错误.
故选B.
本题解析:
本题难度:一般
4、选择题 下列物质间的反应可以用同一个离子反应方程式表示的是( )
A.NaOH与HCl反应和Mg(OH)2与HNO3反应
B.Na2CO3与足量H2SO4反应和K2CO3与足量HCl反应
C.CuSO4与Ba(OH)2反应和CuSO4与BaCl2反应
D.Fe与HCl反应和Fe与CH3COOH反应
参考答案:A.NaOH为强碱,而Mg(OH)2为弱碱,在离子反应中保留化学式,虽都是酸碱中和反应,但不能用同一个离子反应方程式表示,故A不选;
B.反应实质均为碳酸根离子与氢离子反应,能用同一个离子反应方程式表示,故B选;
C.硫酸钡、氢氧化铜在离子反应中均应保留化学式,CuSO4与Ba(OH)2反应生成硫酸钡和氢氧化铜,而CuSO4与BaCl2反应生成硫酸钡和氯化铜,氯化铜为可溶性盐,则不能用同一个离子反应方程式表示,故C不选;
D.HCl为强酸,而为CH3COOH弱酸,在离子反应中保留化学式,虽都是金属与酸的反应,但不能用同一个离子反应方程式表示,故D不选;
故选B.
本题解析:
本题难度:简单
5、选择题 下列离子方程式中正确的是
[? ]
A. 氨水吸收足量的SO2气体:OH-+SO2=HSO3-
B. Na2CO3溶液吸收Br2蒸气:3CO32-+Br2=Br-+BrO3-+3CO2
C. 将铜片投入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
D. NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-= BaSO4↓+H2O
参考答案:D
本题解析:
本题难度:一般