1、选择题 下列除杂(括号内为杂质)所用试剂不正确的是
A.NaHCO3溶液(Na2CO3):CO2
B.铁粉(铝粉):NaOH溶液
C.FeCl3溶液(AlCl3):氨水
D.NaCl溶液(Na2CO3):盐酸
参考答案:C
本题解析:
本题难度:一般
2、选择题 3月11日日本发生9级地震导至福岛核电站发生爆炸,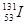 ?、
?、 ?、
?、 ?、
?、 等放射性元素或物质发生泄露。下列说法错误的是
等放射性元素或物质发生泄露。下列说法错误的是
A.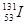 原子核内有78个中子
原子核内有78个中子
B. 的质量数为137
的质量数为137
C. 核外电子数为51
核外电子数为51
D. 、
、 互为同位素
互为同位素
参考答案:C
本题解析:
答案:C
C不正确,核外电子数=质子数=38
本题难度:一般
3、填空题 A、B、C、D、E属于短周期元素,且原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
(1)写出: A?D?(元素符号),乙?(化学式?)
(2)E元素在周期表中的位置是第?周期,第?族。
(3)画出B的原子结构示意图?;
(4)C单质与NaOH溶液反应的离子方程式?;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示)?。
参考答案:(10分)
(1)O? Si, Na2O2?(2)3, ⅥA。?各?1分
(3) ?;?1分
?;?1分
(4) 2Al+2OH-+6H2O = 2[Al(OH)4]-+3H2↑;---2分
(5) 2Al + Fe2O3 Al2O3+2Fe 或4Al + 3MnO2
Al2O3+2Fe 或4Al + 3MnO2 2Al2O3+3Mn ?2分。
2Al2O3+3Mn ?2分。
本题解析:由高纯度的D单质可制造芯片,得知D为Si元素。C、D的单质都能与强碱溶液反应,得知C为Al元素。A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同,得知A为O元素,B为Na元素。A 与E同主族,得知E为S元素。
(1)A为O元素,D为Si元素。乙为Na2O2。
(2)E为S元素,在周期表中的位置是第三周期,第ⅥA族。
(3)B为Na元素,原子结构示意图为 。
。
(4)C为Al元素,与NaOH溶液反应的离子方程式为2Al+2OH-+6H2O = 2[Al(OH)4]-+3H2↑。
(5)C为Al元素,其单质可以用来焊接铁轨和制取金属单质,方程式为2Al + Fe2O3 Al2O3+2Fe,4Al + 3MnO2
Al2O3+2Fe,4Al + 3MnO2 2Al2O3+3Mn。
2Al2O3+3Mn。
点评:本题考查元素位置结构性质关系及应用,题目难度中等,本题侧重于电子式的书写,学习中注意把握书写要点。
本题难度:一般
4、选择题 下列变化规律错误的是
A.微粒半径:F-<Cl-<Br-<I-
B.稳定性:HI<HBr<HCl<HF
C.沸点:HF<HCl<HBr<HI
D.阴离子还原性:F-<Cl-<Br-<I-
参考答案:C
本题解析:由于HF分子中含有氢键,所以沸点比其他的卤化氢的沸点高。
本题难度:一般
5、选择题 下列关于物质性质的比较,不正确的是?
A.金属性强弱:Na>Mg>Al
B.酸性强弱:HIO4>HBrO4>HClO4
C.碱性强弱:KOH>NaOH>LiOH
D.原子半径大小:Na>S>O
参考答案:B
本题解析:A.同周期元素从左到右元素的金属性逐渐减弱,则金属性强弱:Na>Mg>Al,故A正确。
B.非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则有HIO4<HBrO4<HClO4,故B错误;
C.金属性:K>Na>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性强弱:KOH>NaOH>LiOH,故C正确;
D.同周期元素从左到右原子半径逐渐减小,则原子半径Na>S,同主族元素的原子半径从上到下逐渐增大,则原子半径S>O,所以原子半径大小:Na>S>O,故D正确;
故选B。
点评:本题考查元素的性质的递变规律,题目难度不大,注意元素周期律以及元素的性质与元素对应单质、化合物性质的关系。
本题难度:一般