1、填空题 (8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,发生的反应:2MnO4- +16H+ + 10Cl- ="==" 2Mn2+ + 5Cl2↑ + 8H2O.现有一个氧化还原反应中,已知反应物和生成物有KCl、H2SO4、KMnO4、MnSO4、H2O、K2SO4、Cl2
(1)已知该反应中,KMnO4得到电子,写出一个包含上述七种物质的氧化还原反应方程式(不需要配平)?;则反应的还原剂为??
(2)上述反应中,1mol氧化剂在反应中得到?电子
(3)如果在反应后的溶液中加入NaBiO3,溶液又变回紫红 色,请判断下列正确的是
色,请判断下列正确的是
A.氧化性:BiO3->MnO4->Cl2
B.氧化性:BiO3->Cl2>MnO4-
C.氧化性:MnO4->BiO3->Cl2
D.氧化性:Cl2>MnO4->BiO3-
参考答案:(1) KCl + KMnO4 + H2SO4? ?MnSO4 + K2SO4 + Cl2↑ +H2O ;? KCl
?MnSO4 + K2SO4 + Cl2↑ +H2O ;? KCl
(2) 5mol ; (3) A
本题解析:略
本题难度:一般
2、选择题 取ag某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag.下列物质中不能满足上述结果的是( )
A.H2
B.CO
C.C6H12O6
D.C12H22O11
参考答案:D
本题解析:
本题难度:一般
3、填空题 (7分)根据要求回答下列问题
(1) ________________________________?(写名称)
________________________________?(写名称)
(2)2-甲基-2-戊烯?(写结构简式)
(3)键线式 表示的分子式??。
表示的分子式??。
(4)按官能团的不同,对有机物进行分类,请指出下列有机物的种类,填在横线上。
CH3CH2CH2Br? __________;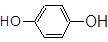 ___________;?
___________;? ________________;
________________; ________________;?
________________;?
参考答案:(1)2,3-二甲基戊烷?(2)(CH3)2C=CHCH2CH3?(3)C6H14?
(4)卤代烃?酚?酯?羧酸
本题解析:(1)根据有机物的结构简式可知,主链有5个碳原子,带两个支链,且都是甲基,所以名称是2,3-二甲基戊烷。
(2)根据名称可知,该有机物的结构简式为(CH3)2C=CHCH2CH3。
(3)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式。所以分子式为C6H14,名称是2-甲基戊烷。
(4)含有溴原子,则属于卤代烃。含有酚羟基,则是酚类。含有酯基则是酯类。含有羧基,则是羧酸类。
本题难度:一般
4、填空题 (4分)(1)写出氯化铁溶液中加入铁粉发生的化学方程式?。
(2)写出乙醇和乙酸在浓硫酸催化下加热反应的化学方程式?。
参考答案:(4分)(1)(2分)2Fe3++Fe=3Fe2+
(2)(2分)(2)化学方程式:CH3COOH+C2H5OH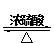 CH3COOC2H5+H2O
CH3COOC2H5+H2O
本题解析:本题考查氧化还原反应离子方程式及酯化反应方程式的写法
(1)氯化铁溶液中加入铁粉,由于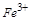 具有较强的氧化性,而的单质
具有较强的氧化性,而的单质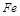 较强的还原性,单质
较强的还原性,单质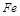 被氧化为
被氧化为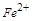 ,
,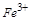 也还原为
也还原为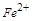 ,其反应的离子方程式为:
,其反应的离子方程式为: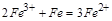 ,书写时要注意左右两侧电荷相等
,书写时要注意左右两侧电荷相等
(2)乙醇和乙酸在浓硫酸催化下加热,发生的是酯化反应,出现分层,上曾为带有香味的乙酸乙酯,下层是水,但同时这个反应是可逆反应,乙酸乙酯水解生成乙酸和乙醇,其反应的化学方程式为: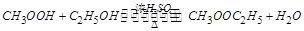 。
。
本题难度:简单
5、选择题 镁、铝、铁三种金属,分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等.则下列说法正确的是( )
A.消耗的三种金属的物质的量相等
B.消耗的三种金属可能都过量
C.消耗的三种金属的质量相等
D.消耗的三种金属可能质量不相等
参考答案:镁、铝、铁三种金属,分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等,则生成氢气的物质的量相等,假定氢气为1mol,反应中镁、铝、铁分别表现+2、+3|+2价,则参加反应的镁、铝、铁三种金属的物质的量分别为1mol、23mol、1mol,
A.由上述分析可知,消耗镁、铝、铁三种金属的物质的量之比为1mol:23mol:1mol=3:2:3,故A错误;
B.由于盐酸的体积、浓度相等,若金属都过量则盐酸完全反应,生成氢气的质量相等,故B正确;
C.由上述分析可知,消耗镁、铝、铁三种金属的质量之比为1×24:23×27:1×56=12:9:28,故C错误;
D.由C中分析可知,消耗镁、铝、铁三种金属的质量之比为12:9:28,消耗的三种金属一定不相等,故D错误;
故选D.
本题解析:
本题难度:一般