1、选择题 在如图所示的装置中,a的金属活泼性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是 ( )。
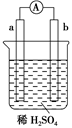
A.碳棒上有气体放出,溶液pH变大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极到b极
D.a极上发生了氧化反应
参考答案:B
本题解析:本题考查原电池基本知识,难度不大,但概念容易混淆。没有扎实的基础知识容易搞错,显然,电极a、b与电解质溶液稀H2SO4组成原电池。因活泼性a>b(碳棒),所以a为电池的负极,b为正极。电极反应式:
a(负)极:a-ne-=an+(氧化反应)
b(正)极:nH++ne-=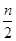 H2↑(还原反应)
H2↑(还原反应)
由于正极放电消耗H+,溶液中c(H+)减小,pH增大,在外电路中,电子由a极流出经电流计A流向b极。
本题难度:一般
2、选择题
电化学在日常生活中用途广泛,图甲是镁—次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含 的工业废水的处理。下列说法正确的是
的工业废水的处理。下列说法正确的是

A.图乙中 向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
B.图乙的电解池中,有0.084 g阳极材料参与反应,阴极会有336 mL的气体产生
C.图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓
D.若图甲中3.6 g镁溶液产生的电量用以图乙废水处理,理论可产生10.7 g氢氧化铁沉淀
参考答案:C
本题解析:
A项,在电解池中,阴离子应该移向阳极,根据装置乙可知,惰性电极做阴极;B项,未标明标准状况,故无法计算产生气体的体积;C项,根据装置甲可知,镁做负极,发生电极反应是Mg-2e-=Mg2+;D项,图甲中溶解3.6 g镁时,失去的电子是0.3 mol,在图乙中阳极反应是Fe-2e-=Fe2+,根据电子守恒可得此时生成的Fe2+是0.15 mol,所以最后生成的氢氧化铁也是0.15 mol即16.05 g。
本题难度:一般
3、填空题 (11分)依据氧化还原反应:2Ag+ (aq) + Cu(s) ="=" Cu2+ (aq) + 2Ag (s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极;银电极上发生的电极反应式 。
(3)外电路中的电子是从 电极流向 电极(填电极的材料)。
(4)利用反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2,设计一个原电池,在下面框图内画出有关的实验装置图:

正极的电极反应式为 。
参考答案:(1)铜(1分);AgNO3溶液(1分)(2)正(1分);Ag+ + e-=Ag(2分)
(3)铜(1分);银(1分)(4) (2分);Fe3++ e-=Fe2+(2分)。
(2分);Fe3++ e-=Fe2+(2分)。
本题解析:(1)根据总的反应式可知,铜失去电子,银离子得到电子,所以铜是负极。X电极插在硫酸铜溶液中,所以X电极是铜,因此电解质溶液Y是硝酸银。
(2)银电极为电池的正极,发生的电极反应式是Ag+ + e-=Ag。
(3)由于在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以外电路中的电子是从铜电极流向银电极。
(4)根据反应Zn + 2 FeCl3 = ZnCl2 + 2 FeCl2可知,锌是还原剂,失去电子,氯化铁是氧化剂得到电子。所以在原电池中锌是负极,正极材料可以是石墨或金属性弱于锌的金属等,而电解质溶液是氯化铁,所以装置图为 。其中正极的电极反应式为Fe3++ e-=Fe2+。
。其中正极的电极反应式为Fe3++ e-=Fe2+。
本题难度:一般
4、选择题 下列各装置中,不能构成原电池的是(电解质都为稀硫酸)

参考答案:D
本题解析:构成原电池的条件之一为形成闭合回路,选D。
考点:考查原电池工作原理。
本题难度:一般
5、选择题
.?如右图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。

下列叙述正确的是(?)
A.Zn是负极,发生还原反应
B.电流从锌片流向铜片
C.一段时间后,铜片质量减轻
D.该装置将化学能转变为电能
参考答案:D
本题解析:Zn是负极,发生氧化反应,电流是正电荷的流动方向,铜片作电极,在该反应中不参加化学反应。
本题难度:简单