| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《水的电离平衡》高频试题强化练习(2017年最新版)(二)
参考答案:B 本题解析:分析:先计算硝酸铵和氢氧化钡的物质的量,再利用硝酸铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少. 本题难度:一般 2、选择题 下列操作会促进H2O的电离,且使溶液pH>7的是 ( ) |
参考答案:B
本题解析:A.水的电离是吸热过程。将纯水加热到90 ℃,可以促进水的电离,C(H+)增大,溶液的PH减小。小于7.错误。B. 向水中加少量Na2CO3溶液发生反应H2O+CO32- HCO3-+OH-。水的的程度增大,由于消耗了H+,所以最终溶液中的OH-离子的浓度增大,溶液的PH增大,大于7。正确。C. 向水中加少量NaOH溶液 对水的电离起到了抑制作用,水的电离程度减小,整个溶液中的氢氧根离子增大,溶液的PH增大,大于7.不符合题意。错误。D. 向水中加少量FeCl3溶液,发生反应3H2O+Fe3+
HCO3-+OH-。水的的程度增大,由于消耗了H+,所以最终溶液中的OH-离子的浓度增大,溶液的PH增大,大于7。正确。C. 向水中加少量NaOH溶液 对水的电离起到了抑制作用,水的电离程度减小,整个溶液中的氢氧根离子增大,溶液的PH增大,大于7.不符合题意。错误。D. 向水中加少量FeCl3溶液,发生反应3H2O+Fe3+ Fe(OH)3+3H+。 促进了水的电离,整个溶液显酸性,PH小于7.不符合题意错误。
Fe(OH)3+3H+。 促进了水的电离,整个溶液显酸性,PH小于7.不符合题意错误。
考点:考查外界条件对水的电离的影响及溶液的酸碱性。
本题难度:一般
3、选择题 对于溶液的酸碱性说法正确的是
A.c(H+)很小的溶液一定呈碱性
B.pH等于7的溶液一定呈中性
C.c(H+)=c(OH-)的溶液一定呈中性
D.不能使酚酞试液变红的溶液一定呈酸性
参考答案:C
本题解析:A.c(H+)很小的溶液不一定呈碱性,只有氢离子浓度小于氢氧根浓度时溶液才能显碱性,A错误;B.pH等于7的溶液不一定呈中性,在100℃时显碱性,B错误;C.c(H+)=c(OH-)的溶液一定呈中性,C正确;D.不能使酚酞试液变红的溶液不一定呈酸性,因为酚酞的变色范围是8.2~10.0,D错误,答案选C。
考点:考查溶液酸碱性判断
本题难度:一般
4、选择题 水的电离平衡曲线如图所示.下列说法正确的是( )
A.图中对应点的温度关系为:a>b
B.水的电离常数KW数值大小关系为:b>d
C.温度不变,加入少量NaOH可使溶液从c点变到a点
D.在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性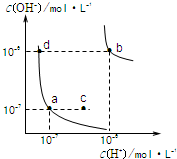
参考答案:B
本题解析:
本题难度:简单
5、填空题 (10分)(1)某温度(t℃)时,水的Kw=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b ;
②若所得混合液的pH=2,则a∶b ;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值__ _7,混和前c(NH3·H2O)_ _ c(HCl),氨水中c(OH-) _盐酸中c(H+)。(填>、<或=,下同)
参考答案:(1)10∶1 (2分) 9∶2 (2分)
(2)=" " > <(每空2分)
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《分子式、结.. | |