|
|
|
高考化学试题《水的电离平衡》高频试题强化练习(2017年最新版)(十)
2017-11-05 23:53:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 向水中分别加入下列溶液,对水的电离平衡不产生影响的是
A.KHSO4溶液
B.KHCO3溶液
C.KHS溶液
D.KI溶液
|
参考答案:D
本题解析:KHSO4溶液电离出大量氢离子,抑制水的电离,故A错误;KHCO3溶液中,HCO3-水解能促进水电离,故B错误;KHS溶液,HS—水解程度大于电离,能促进水电离,故C错误;KI溶液为强酸强碱盐,故D正确。
考点:本题考查水的电离。
本题难度:简单
2、实验题 (14分)重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。 12Na2CrO4+3Fe2O3+7KCl+12H2O。

(1)碱浸前将铬铁矿粉碎的作用 。
(2)反应器①中除发生题中所给反应外,请写出其他两个化学方程式(要求两个反应中反应物均不相同) ; 。③中调节PH=7-8所得滤渣为 、 。
(3)从平衡角度分析④中酸化的原理 ;
(4)用简要的文字说明操作⑤加入KCl能得到K2Cr2O7晶体的原因是 。
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,向其中加入10mL2mol/ LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O32—=2I—+S4O62—)
①判断达到滴定终点的依据是 ;
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度为(设整个过程中其它杂质不参加反应) (保留2位有效数字)。
参考答案:(14分)
(1)增大接触面积,增大反应速率
(2)SiO2+2NaOH= Na2SiO3 + H2O;Al2O3 +Na2CO3= 2NaAlO2 + CO2.
或Al2O3 +2NaOH= 2NaAlO2 + H2O ;SiO2 +Na2CO3= Na2SiO3 + CO2. Al(OH)3、H2SiO3
(3)2CrO42—+2H+ Cr2O72—+H2O增大H+浓度平衡右移 Cr2O72—+H2O增大H+浓度平衡右移
(4)重铬酸钾的溶解度较小且受温度影响较大
(5)①当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪色,且振荡后半分钟内不恢复
②0.94或94%
本题解析:(1)工业上为了增大接触面积,加快化学反应速率,经常在碱浸前将铬铁矿粉碎,
(2)工业上常用的铬铁矿主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3,加入纯碱、固体NaOH发生的反应有:SiO2+2NaOH= Na2SiO3 + H2O;Al2O3 +Na2CO3= 2NaAlO2 + CO2或Al2O3 +2NaOH= 2NaAlO2 + H2O ;SiO2 +Na2CO3= Na2SiO3 + CO2,浸取过滤后的滤液中含有Na2CrO4,NaAlO2和Na2SiO3 ③中调节PH=7-8,滤液中含有的杂质Na2SiO3和NaAlO2,二者都水解显碱性,降低pH有利于两种盐水解产生沉淀,从而除去,滤液为Na2CrO4,则所得滤渣为Al(OH)3、H2SiO3。
(3)④中酸化的原理为2CrO42—+2H+ Cr2O72—+H2O增大H+浓度平衡右移。 Cr2O72—+H2O增大H+浓度平衡右移。
(4)向K2Cr2O7溶液中加入KCl固体,加热时,K2Cr2O7的溶解度随温度的升高而增大,但是KCl的溶解度受温度影响不大,所以加热蒸发使KCl结晶析出后趁热过滤,再将滤液冷却结晶,得K2Cr2O7晶体,则操作⑤加入KCl能得到K2Cr2O7晶体的原因是重铬酸钾的溶解度较小且受温度影响较大.
(5)①淀粉遇碘显蓝色,加入硫代硫酸钠溶液将碘反应完全后溶液呈无色,所以该滴定反应无需指示剂,则判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液,溶液蓝色褪色,且振荡后半分钟内不恢复。
②整个滴定过程发生的化学反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-,得到关系式为Cr2O72-~3I2~6S2O32-,所以K2Cr2O7纯度=(0.12×0.04×1/6×10×294)÷2.5×100%=94%。
考点:考查工业生产重铬酸钾的流程分析,物质的除杂,中和滴定等知识
本题难度:困难
3、选择题 下列各电离方程式中,错误的是( )
A.NaOH=Na++O2-+H+
B.Na2SO4=2Na++SO42-
C.HNO3=H++NO3-
D.MgCl2=Mg2++2Cl-
参考答案:A、NaOH为强电解质,电离方程式为NaOH=Na++OH-,故A错误;
B、Na2SO4为强电解质,电离方程式为Na2SO4=2Na++SO42-,遵循质量守恒定律和电荷守恒,故B正确;
C、HNO3为强电解质,电离方程式为HNO3=H++NO3-,遵循质量守恒定律和电荷守恒,故C正确;
D、MgCl2为强电解质,电离方程式为MgCl2=Mg2++2Cl-,遵循质量守恒定律和电荷守恒,故D正确;
故选A.
本题解析:
本题难度:简单
4、选择题 若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为
A.10∶1
B.5∶1
C.1∶1
D.1∶10
|
参考答案:B
本题解析:H2SO4+2NaOH=Na2SO4+2H2O,所以硫酸与氢氧化钠物质的量之比是1:2;设硫酸的物质的量浓度为c,体积为V,氢氧化钠溶液浓度为10-3mol/l,体积为10V,则硫酸与氢氧化钠物质的量之比=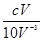 =1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。
=1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。
考点:考查酸碱混合时的定性判断及有关ph的计算。
本题难度:一般
5、选择题 下列操作会使H2O的电离平衡向电离方向移动且pH<7的是( )
A.向水中加少量Na2CO3
B.向水中加少量FeCl3
C.向水中加少量NaHSO4
D.向水中加入少量NaCl
参考答案:B
本题解析:
本题难度:简单
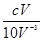 =1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。
=1:2,解得c=5×10-3mol/l,则二者物质的量浓度之比应为5×10-3mol/l:10-3mol/l=5:1答案选B。