| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《水的电离平衡》高频试题强化练习(2017年最新版)(八)
参考答案:B 本题解析:盐酸是强酸,醋酸是弱酸,当pH相同时,醋酸浓度大,稀释过程中,电离平衡右移,H+浓度减小程度小,稀释后pH仍相同,醋酸加水多,选B。 本题难度:一般 2、选择题 室温时,柠檬水溶液的pH是3,其中的c(OH-)是 |
参考答案:B
本题解析:柠檬水溶液的pH是3,则氢离子浓度是0.001mol/L,则根据水的离子积常数可知,溶液中c(OH-)=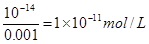 ,答案选B。
,答案选B。
考点:考查溶液中离子浓度的有关计算
点评:在计算溶液中OH-浓度时,应该充分利用好水的离子积常数和pH的定义式。
本题难度:一般
3、选择题 25 ℃时,某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
参考答案:D
本题解析:
A、若加入适量氨水至碱性,溶液中存在c(CH3COO-)+c(OH-)=c(Na+)+c(NH4+)+c(H+),因为c(OH-)>c(H+),则c(CH3COO-)<c(Na+)+c(NH4+),故A错误;
B、由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合生成强碱弱酸盐CH3COONa,溶液呈碱性,与溶液的酸性不符,故B错误;
C、根据电荷守恒有c(CH3COO-)+c(OH-)=c(H+)+c(Na+),若溶液中c(CH3COO-)>c(Na+)>c(OH-)>c(H+),则c(CH3COO-)+c(OH-)>c(H+)+c(Na+),溶液不呈电中性,故C错误;
D、pH=3的CH3COOH与pH=11的NaOH溶液等体积混合,醋酸过量,溶液呈酸性,且溶液中存在Na+、CH3COO-、H+、OH-四种离子,故D正确。
考点:考查溶液中的离子平衡、离子浓度的关系
点评:本题考查了溶液中的离子平衡、离子浓度的关系,难度中等。解题时应注意根据各选项的溶液组成情况,结合电荷守恒的关系式逐个分析。
本题难度:困难
4、填空题 (14分)求25℃时以下溶液的pH
(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH= ____________
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH= ____________
(3)pH=9的NaOH溶液稀释到原来的10倍后,pH= ____________,再稀释到原来的1000倍后,pH___________。
(4)pH=12的NaOH和pH= 4的HCl等体积混合后,pH= ____________
(5)pH=10的NaOH和pH=1的HCl等体积混合后,pH= ____________
(6)pH=12的NaOH和pH=2的HCl等体积混合后,pH= ____________
参考答案:26.(14分)(1) 3.3,(2) 11.7, (3) 8 ,≈7 ,(4) 11.7,(5) 1.3, (6) 7
本题解析:(1)设两种酸的体积都是1L,pH=3的盐酸与pH=5的硫酸等体积混合后,混合溶液中氢离子浓度=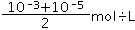 =5.05×10-4mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
=5.05×10-4mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
(2)(2)设两种碱的体积都是1L,pH=10和pH=12的两种NaOH溶液等体积混合后,混合溶液中氢氧根离子浓度=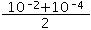 mol/L=5.05×10-3mol/L,则混合溶液中氢离子浓度=
mol/L=5.05×10-3mol/L,则混合溶液中氢离子浓度=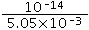 mol/L=2×10-12mol/L,pH=11.7,
mol/L=2×10-12mol/L,pH=11.7,
(3)强碱溶液稀释10倍是溶液的pH减小1,所以pH=9的NaOH溶液稀释到原来的10倍后,pH=8,再稀释到原来的1000倍后,溶液接近中性,则pH≈7,
(4)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=4的HCl中c(H+)=0.0001mol/L,等体积混合后,混合溶液中c(OH-)=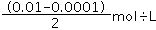 =5.05×10-3mol/L,则混合溶液中氢离子浓度=
=5.05×10-3mol/L,则混合溶液中氢离子浓度=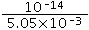 mol/L=2×10-12mol/L,pH=11.7,
mol/L=2×10-12mol/L,pH=11.7,
(5)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=1的HCl中c(H+)=0.1mol/L,等体积混合后,混合溶液中氢离子浓度= =0.045mol/L,pH=1.3,
=0.045mol/L,pH=1.3,
(6)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=2的HCl中c(H+)=0.01mol/L,等体积混合后,酸和碱的物质的量相等,则溶液呈中性,pH=7,
考点:考查混合溶液PH的计算。
本题难度:一般
5、选择题 将20mL0.4 mol·L-1硝酸铵溶液跟50mL 0.1 mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是
A.c(NO3-)> c(OH-)> c(NH4+) > c(Ba2+)
B.c(NO3-) > c(Ba2+) > c(OH-) > c(NH4+)
C.c(Ba2+) > c(NO3-) > c(OH-) > c(NH4+)
D.c(NO3-) > c(Ba2+) > c(NH4+) > c(OH-)
参考答案:B
本题解析:分析:先计算硝酸铵和氢氧化钡的物质的量,再利用硝酸铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少.
解:20mL 0.4mol/L硝酸铵溶液中硝酸铵的物质的量为20mL×10-3L×0.4mol/L=0.008mol,
50mL 0.1mol/L氢氧化钡溶液中氢氧化钡的物质的量为50mL×10-3L×0.1mol/L=0.005mol,
硝酸铵和氢氧化钡混合以后发生反应:2NH4NO3+Ba(OH)2=Ba(NO3)2+2NH3?H2O,
则反应后,70ml溶液的组成为:剩余氢氧化钡0.001mol,生成的硝酸钡0.004mol,生成的一水合氨0.008mol,
在体积一样的前提下,物质的量越大,浓度越大,故c(NO3-)>c(Ba2+),
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.002mol的氢氧根,所以c(OH-)>c(NH4+),
故离子浓度大小顺序为:c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+).
故选B.
点评:本题考查学生溶液混合以后离子浓度大小的比较问题,关键是找出反应以后溶液的组成以及各个离子的量的多少,是现在高考的热点和难点.
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《分子式、结.. | |