1、选择题 以白云石(CaCO3·MgCO3)为原料冶炼金属镁的反应工艺涉及以下两个反应:
①CaCO3·MgCO3?MgO·CaO+2CO2↑;②2(MgO·CaO)+Si?2CaO·SiO2+2Mg↑
对①②两个反应的说法疋确的是?(?)
A.在敞口容器中有利于反应①的进行
B.反应①能进行,说明该反应△H<O
C.在真空条件下有利于反应②的进行
D.反应②能进行,说明Si的还原性比Mg强
参考答案:AC
本题解析:略
本题难度:一般
2、选择题 下列物质与HNO3反应时,硝酸既表现出强氧化性又表现出酸性的是:
A.Fe2O3
B.FeS
C.Cu(OH)2
D.C
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (8分)(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vitc,可使食物中的Fe3+转化为Fe2+。
①人体中经常进行Fe2+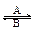 Fe3+的转化,在过程A中,Fe2+做?剂,过程B中Fe3+做?剂。
Fe3+的转化,在过程A中,Fe2+做?剂,过程B中Fe3+做?剂。
②Vitc使Fe3+转化为Fe2+,Vitc在这一过程中做?,具有?性。
(2)写出下列反应的化学方程式,并注明氧化剂、还原剂
①“曾青得铁化为铜”:?;
②用CO还原Fe2O3炼铁:?。
参考答案:(1)①还原,氧化?②还原剂,还原
(2)①Fe+CuSO4=Cu+FeSO4?氧化剂:CuSO4;还原剂:Fe
②3CO+Fe2O3=2Fe+3CO2氧化剂:Fe2O3; 还原剂:CO
本题解析:(1)①过程A:Fe化合价由+2升高到+3,被氧化,Fe2+做还原剂,过程B:Fe化合价由+3降低到+2,被还原,Fe3+做氧化剂。②Vitc使Fe3+转化为Fe2+,Fe3+被还原,可推知:Vitc在这一过程中被氧化,做还原剂,具有还原性。
(2)①CuSO4中Cu的化合价降低,做氧化剂,Fe的化合价升高,做还原剂;②CO中C的化合价升高,做还原剂,Fe2O3中Fe的化合价降低,做氧化剂。
本题难度:简单
4、填空题 (8分)(1)(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.
反应中氧化产物和还原产物的物质的量之比为 。
(2)将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为 ;氧化产物是 ; 若生成2molNO,反应中电子转移的总物质的量为 mol。
参考答案:(1)1:3(2)3K2S+8HNO3=2NO+3S+6KNO3+4H2O S 6
本题解析:略
本题难度:一般
5、填空题 X2、Y2单质在一定条件下有如下反应:X2+Y2+H2O→HXO3+HY(未配平).
按要求回答下列问题:
(1)X2、Y2可能的组合是______.
a.F2、Br2b.I2、Cl2c.C12、O2d.Br2、N2
(2)试比较X2、Y2、HXO3的氧化性强弱:______[用(1)中所选的X2、Y2回答,下同].判断HXO3+HX能否反应:______(填“能”或“不能”).若能反应,请写出其化学反应方程式,若不能反应,请说明理由:______.
(3)若用KX制取HX,不能选用浓硫酸的原因是______.(用化学方程式表示)
(4)工业上测定某产品中YO-的含量,先将一定量产品的溶液加入过量的KX溶液和稀硫酸中,使之反应生成X2,试写出上述反应的离子方程式:______.
(5)Fe2+、Fe3+、X2、X-、Y-五种微粒中的两种微粒A(阳离子)和B在溶液中能相互反应生成X2,向含微粒A的溶液中滴入足量lmol/LNa2S溶液,生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D再与稀硫酸完全反应生成E溶液.则生成的沉淀C的成份是(填化学式)______.E溶液中阳离子除H+外,另外的阳离子的检验方法是______.
参考答案:(1)X由0价变成+5价,化合价升高5价,1分子X2反应至少升高10价;Y有0价变成-1价,化合价降低2价,1分子Y2反应至少降低2价,化合价变化的最小公倍数为10,所以Y2的化学计量数为5,X2的化学计量数为1,再根据观察法配平其它物质的化学计量数,配平后的反应方程式为X2+5Y2+6H2O=2HXO3+10HY,反应中,氧化性关系为:X2<Y2,
a.Br2 F2,氟单质在溶液中与水反应,不能够氧化溴单质,故a错误;
b.I2 C12,氯气氧化性大于碘单质,在溶液中能够将碘单质氧化成碘酸,故b正确;
C.C12 O2,氧气在溶液中不能够将氯气氧化成氯酸,故c错误;
d.N2 Br2,氮气的稳定性很强,溴不能将氮气氧化成硝酸,故d错误;
故答案为:b;
(2)根据方程中氧化性:氧化剂>氧化产物>还原产物>还原剂,所以氧化性:Cl2>HIO3>I2;HIO3+5HI=3I2+3H2O,所以HXO3+HX能反应;
故答案为:Cl2>HIO3>I2;能;HIO3+5HI=3I2+3H2O;
(3)浓硫酸有强氧化性能氧化HI,用KI制取HI,不能选用浓硫酸,其原因是2HI+H2SO4(浓)=SO2↑+I2+2H2O,
故答案为:2HI+H2SO4(浓)=SO2↑+I2+2H2O;
(4)一定量ClO-的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,其反应的离子方程式:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(5)A(阳离子)和B在溶液中能相互反应生成X2,则A为Fe3+,B为I-;向含Fe3+的溶液中滴入足量l mol/LNa2S溶液,其反应为2Fe3++S2-=2Fe2++S↓,
Fe2++S2-=FeS↓,所以生成的沉淀C为S和FeS;生成的沉淀C与足量的热NaOH溶液反应,过滤,残渣D为FeS再与稀硫酸完全反应生成FeSO4溶液;检验Fe2+的存在,先加硫氰化钾溶液,如果无现象,再加氯水,溶液变红色,说明含有Fe2+,
故答案为:FeS和S;取少量E 溶液滴入KSCN溶液时无现象,再向其中滴入氯水后溶液呈血红色,则E溶液中有Fe2+.
本题解析:
本题难度:一般