1、选择题 在密闭容器中盛有H2、O2、Cl2混合气体,通过电火花引燃,气体恰好完全反应,冷却至室温后,所得液体产物中HCl的质量分数为25.62%,则容器中原有H2、O2、Cl2分子个数比为(?)
A.6∶3∶2
B.9∶6∶1
C.10∶6∶1
D.13∶6∶1
参考答案:D
本题解析:设有100 g溶液,则其中HCl:25.62 g即0.705 mol。
含H2O:74.38 g即4.13 mol,故n(Cl2)= mol,n(O2)=
mol,n(O2)=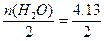 mol,n(H2)=
mol,n(H2)=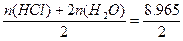 mol。
mol。
故n(H2)∶n(O2)∶n(Cl2)=13∶6∶1。
本题难度:简单
2、选择题 下列推断合理的是( )
A.新制氨水中共含有NH3和H2O两种分子
B.新制氯水光照后有气体逸出,该气体是Cl2
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.由于浓硝酸具有强氧化性,故在常温下就可以将铁氧化
参考答案:A.氨气溶于水时,存在下列平衡NH3+H2O?NH3.H2O?NH4++OH-,所以溶液中存在NH3、H2O、NH3.H2O三种分子,故A错误;
B.氯气溶于水发生的反应为:Cl2+H2O=HCl+HClO,新制氯水光照时发生的反应为,2HClO?光照?.?2HCl+O2↑,所以生成的气体是氧气,故B错误;
C.浓硫酸具有强氧化性,但常温时和铜不反应,在加热时能和铜反应生成二氧化硫,故C错误;
D.常温时,浓硝酸和铁发生钝化现象从而阻止了进一步反应,故D正确;
故选D.
本题解析:
本题难度:一般
3、实验题 某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。
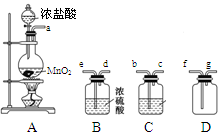
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是____________________________________________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
?
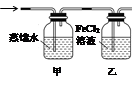
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)___________________________。
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2+2H2O(2分)?(2)bcedf(2分)
Mn2++Cl2+2H2O(2分)?(2)bcedf(2分)
(3)吸收水蒸气,干燥氯气(1分)?饱和食盐水(1分)?(4) (2分)
(2分)
(5)Cl2、HClO、ClO-(2分)? KSCN溶液(1分)?溶液变成红色(1分)
本题解析:(1)根据装置特点以及试剂可知,装置A是用来准备氯气的,所以A中发生反应的离子方程式为MnO2+4H++2Cl- Mn2++Cl2+2H2O。
Mn2++Cl2+2H2O。
(2)由于盐酸易挥发,所以生成的氯气中含有氯化氢以及水蒸气,因此在收集氯气之前需要首先除去氯化氢和水蒸气。首先除去的是氯化氢,所用试剂是饱和食盐水,然后在通过盛有浓硫酸的洗气瓶除去水蒸气。氯气的密度大于空气的,应该用向上排空气法收集,所以按照气流方向各仪器接口的连接顺序为a→b→c→e→d→f→g。
(3)根据以上分析可知,装置B中浓硫酸的作用是吸收水蒸气,干燥氯气;由于氯化氢极易溶于水,而氯气你溶于水,所以要除去氯气中的氯化氢气体最好选用饱和食盐水。
(4)氯气有毒,属于大气污染物,需要尾气处理。氯气能被氢氧化钠溶液吸收,所以可以用氢氧化钠溶液吸收,装置图为 。
。
(5)甲装置中盛有蒸馏水,氯气溶于水部分氯气与水反应生成盐酸和次氯酸,次氯酸是弱酸电离出氢离子和ClO-,所以甲装置溶液中具有氧化性的含氯粒子是Cl2、HClO、ClO-;氯气具有强氧化性,乙装置中盛有氯化亚铁溶液,能和氯气反应生成氯化铁。铁离子能和KSCN溶液反应而使溶液显红色,据此可以检验乙装置中FeCl2溶液与Cl2发生了反应。
本题难度:一般
4、选择题 SO2和Cl2都具有漂白性,若将相同状况下等体积的这两种气体同时作用于潮湿的有色物质,可观察到的现象是(? )
A.立刻褪色
B.慢慢褪色
C.先褪色,后复原
D.颜色不褪
参考答案:D
本题解析:氯气具有强氧化性,SO2具有还原性,二者发生反应的方程式为Cl2+SO2+2H2O=H2SO4+2HCl,等体积混合后,失去漂白性,答案选D。
本题难度:一般
5、选择题 漂白粉在空气中放置易失效的主要原因是
A.Ca(ClO)2不稳定,易分解
B.Ca(ClO)2易吸收水分而潮解
C.Ca(ClO)2跟空气中的水和CO2反应
D.Ca(ClO)2跟空气中的O2反应
参考答案:C
本题解析:次氯酸的酸性弱于碳酸,故Ca(ClO)2跟空气中的水和CO2反应,生成次氯酸和碳酸钙,次氯酸见光分解从而失效。故答案为C。
本题难度:一般