1、选择题 向20mL 10mol/L的浓盐酸中加入足量的二氧化锰固体上并加热,若不考虑HCl的挥发,则被氧化的HCl的物质的量为……( ?)
A.小于0.1mol
B.等于0.1mol
C.大于0.1mol,小于0.2mol
D.等于0.2mol
参考答案:A
本题解析:因随着反应进行,浓盐酸变为稀盐酸,而不再能制备Cl2。
说明:高中阶段这一问题不应该有争议。
本题难度:一般
2、选择题 下列物质中,能用作自来水厂消毒剂的是
[? ]
A.活性炭
B.磺化煤
C.明矾
D.液氯
参考答案:D
本题解析:
本题难度:简单
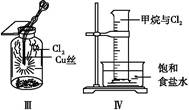
3、选择题 某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
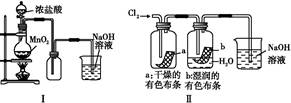
A.Ⅰ图中:如果MnO2过量,盐酸可全部被消耗
B.Ⅱ图中:湿润的有色布条褪色,证明Cl2有漂白性
C.Ⅲ图中:生成棕色的固体,证明Cl2有强氧化性
D.Ⅳ图中:光照后量筒中气体体积减小,说明甲烷与Cl2发生了加成反应
参考答案:C
本题解析:Ⅰ图中随着反应进行浓盐酸变为稀盐酸,MnO2与之不反应,A项错误;Cl2使湿润的有色布条褪色是因为Cl2与水反应:Cl2+H2O HCl+HClO,其中HClO具有漂白性,B项错误;CH4与Cl2在光照条件下发生取代反应,D项错误。
HCl+HClO,其中HClO具有漂白性,B项错误;CH4与Cl2在光照条件下发生取代反应,D项错误。
本题难度:一般
4、填空题 (8分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑ +2H2O
+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是?。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
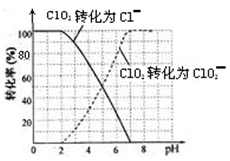
①请写出pH≤2 .0时ClO2--与I-反应的离子方程式?。
②请完成相应的实验 步骤:
步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:?。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2?mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为? ?mol·L-1(用含字母的代数式表示)。
?mol·L-1(用含字母的代数式表示)。
参考答案:(8分)⑴方法 二制备的ClO2中不含Cl2(2分)
二制备的ClO2中不含Cl2(2分)
⑵①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②调节溶液的pH≤2.0(2分)?③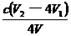 (2分)
(2分)
本题解析:略
本题难度:一般
5、填空题 新制的氯水显______色,这是因为氯水中有______分子(填微粒符号)存在,向氯水中滴入几滴AgNO3溶液,观察到的现象是______,说明氯水中有______(填微粒符号)存在.蓝色石蕊试纸遇到氯水后,首先变红,得很快又褪色,这是因为______氯水经光照后,黄绿色逐渐消失,并放出气体,该反应化学方程式是______.
参考答案:新制氯水中存在Cl2+H2O?H++Cl-+HClO,因氯气可溶于水,新制的氯水显黄绿色,这是因为氯水中有Cl2分子,含有Cl-,向氯水中滴入几滴AgNO3溶液,观察到的现象是有白色沉淀生成,溶液呈酸性,可使石蕊变红,但同时含有强氧化性的次氯酸,可氧化石蕊,则可观察到蓝色石蕊试纸遇到氯水后,首先变红,得很快又褪色,光照时,次氯酸发生2HClO光.2HCl+O2,可观察到黄绿色逐渐消失,并放出气体,
故答案为:黄绿;Cl2;有白色沉淀生成;Cl-;氯水中存在H+呈酸性,因而使试纸变红,但同时存在HClO分子,HClO具有强氧化性,使有色物质褪色,因而红色随即消失;2HClO光.2HCl+O2.
本题解析:
本题难度:一般