1、选择题 某元素的原子序数为7,对它的认识有错误的是
A.它处于元素周期表中第二周期VA族
B.它的最高正价为+5,负价为-3
C.它的最高价氧化物对应水化物是一种强酸
D.它的非金属性比磷弱比氧强
参考答案:D
本题解析:
答案:D
A.正确,两个电子层,最外层5个电子,它处于元素周期表中第二周期VA族;
B.正确,最外层5个电子,它的最高正价为+5,负价为-3
C.正确,它的最高价氧化物对应水化物是一种强酸:HNO3;
D.不正确,它的非金属性比磷强比氧弱:非金属性O>N>P
本题难度:一般
2、选择题 美国劳伦斯·利弗莫尔国家实验室2006年成功合成了118号超重元素,并观察到其存在了不到1毫秒时间。该元素符号为:Uuo,质量数为293,以下叙述不正确的是
A.该元素原子核外含有118个电子,核内有175个中子
B.该元素属于第七周期
C.该元素一定是一种金属元素
D.该元素位于零族
参考答案:C
本题解析:由元素周期表各周期元素个数可知118元素为第七周期的零族元素,不会是金属元素。
本题难度:一般
3、填空题 (8分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是?;X与氢元素形成的化合物的是?。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D 与Y相邻,则D的离子
与Y相邻,则D的离子 结构示意图是?;D与E能形成
结构示意图是?;D与E能形成 一种非极性分子,该分子的结构式为?;D所在族元素的氢化物中,沸点最低的是?。
一种非极性分子,该分子的结构式为?;D所在族元素的氢化物中,沸点最低的是?。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是?.
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为?。
参考答案:(1)CaCl2。
(2)
S=C=S;H2S。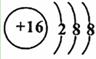
(3)Si3N4。
(4)2F2+2OH—=2F—+OF2+H2O。
本题解析:略
本题难度:一般
4、填空题 不能说明氧元素比硫元素非金属性强的事实是
A.热稳定性H2O比H2S强
B.H2S水溶液在空气中变浑浊
C.H2O比H2S的沸点高
D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S
参考答案:C
本题解析:A中利用的是原子的得电子能力越强,即元素的非金属性越强,则气态氢化物越稳定;B中2H2S+O2=2S+2H2O,则氧化性:O2>S,单质的氧化性越强,说明原子的得电子能力越强,即元素的非金属性越强;D中O2将Cu氧化到+2价,S将Cu氧化到+1价,说明氧化性:O2>S,单质的氧化性越强,说明原子的得电子能力越强,即元素的非金属性越强;
本题难度:一般
5、填空题 (14分) A、B、C、D四种短周期元素的原子序数依次增大,B的核电荷数是A、D核电荷数之和的2/3;A能分别与B、C、D形成电子总数相等的分子X、 Y、Z。回答下列问题:
Y、Z。回答下列问题:
(1)B、D两元素的名称分别是________、______。
(2)化合物B2A2的电子式为________。
(3)Y与C的最高价氧化物的水化物刚好完全反应时,其生成物的水溶液呈_____性(填“酸”、“碱”或“中”),原因是:?(用离子方程式表示)。
(4)在(3)所得生成物的水溶液中,存在如下关系,用离子浓度符号填写:
①c(H+) +?= c(OH 一) +?;
一) +?;
②c(H+)=c(OH一) + ?。
(5)用X、D2、NaOH溶液和惰性电极可设计一种燃料电池,该燃料电池的
负极反应为:?。
正极反应为:?。
参考答案:
(1)碳、氧
(2)
(3)酸,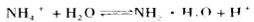
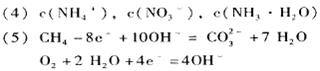
本题解析:略
本题难度:一般