1、填空题 五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,E元素的一种同位素常用于考古断代,D和X同主族,F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,X和Z形成的二元化合物是厨房常用的调味品。回答下列问题:
(1)①E元素在元素周期表中的位置是_______________。
②由D和F,Y,Z所形成的最简单常见共价型化合物中,热稳定性最差的是__________(用化学式表示,下同);还原性最强的是_____________。
③F、X、Z形成的简单离子半径从大到小顺序为_________________(用离子符号表示)
④D、F、Z形成一种离子化合物,写出它的电子式________________________。
(2)①2012年,罗马大学科学家制造出F4分子,则F4和F2两种单质的关系是____________。
②F、X形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,,则该物质的化学式为___________。
③Z单质和FD3发生置换反应,观察到有大量白烟生成,写出该反应化学方程式__________,反应中氧化剂和还原剂物质的量之比为____________________。
参考答案:
(1)①第2周期IVA族(1分);②PH3(1分);PH3(1分);③Cl->N3->Na+(1分),④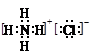
(2)①同分异构体(1分);②NaN3(2分);③Cl2+8NH3==N2+6NH4Cl(1分);3:2(2分)
本题解析:五种短周期元素D、E、F、X、Y、Z的原子序数依次增大,D、E两元素最高正价与最低负价之和均为0,可能是H、C或Si元素;E元素的一种同位素常用于考古断代,是C元素、D是H元素;D(H)和X同主族,X是Na元素;F和Y同主族,F的多种化合物可用作化肥,豆科植物的根瘤菌可将其单质转化为化合物,F是N元素,Y是P元素;X(Na)和Z形成的二元化合物是厨房常用的调味品,Z是Cl元素。
(1)①E(C元素)元素在元素周期表中的位置是第2周期IVA族。
②由D(H)和F(N),Y(P),Z(Cl)所形成的最简单常见共价型化合物中,热稳定性最差的是PH3;还原性最强的是PH3。
③F(N)、X(Na)、Z(Cl)形成的简单离子半径遵循“阴盛阳衰”,从大到小顺序为Cl->N3->Na+;
④D、F、Z形成一种离子化合物是NH4Cl,它的电子式是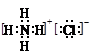 。
。
(2)①同种元素形成的F4(N4)和F2(N2)两种单质互为同素异形体。
②F(N)、X(Na)形成的一种二元离子化合物具有非常强的爆炸性,该物质中X的质量分数是35.38%,
ω(Na)=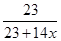 ×100%=35.38%,x=3,
×100%=35.38%,x=3,
故该物质的化学式为NaN3。
③Z单质(Cl2)和FD3(NH3)发生置换反应,观察到有大量白烟生成(NH4Cl),故该反应化学方程式为Cl2+8NH3==N2+6NH4Cl;反应中氧化剂和还原剂物质的量之比为3:2。
本题难度:一般
2、选择题 下列氧化物按其形成的含氧酸酸性递增排列的顺序是(?)
A.SiO2<CO2<SO3<P2O5
B.SiO2<CO2<P2O5<SO3
C.CO2<SiO2<P2O5<SO3
D.CO2<P2O5<SO3<SiO2
参考答案:B
本题解析:元素的非金属性越强,其最高价氧化物对应水化物的酸性就越强。对于Si、P、S具有相同电子层数的元素,原子序数越大、半径越小,非金属性就越强,而C与Si最外层都有4个电子,Si比C多一层电子,C的非金属性比Si强。另外,结合硫酸是强酸,磷酸是中强酸,而碳酸是弱酸等相关知识,也可得出答案。
本题难度:一般
3、选择题 已知A、B、C、D四种短周期元素,它们的核电荷数A<B<C<D。其中A、B、C是同一周期的非金属元素。化合物DC为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。下列说法正确的是
A.A、B、C的氢化物的沸点逐渐降低
B.最高价氧化物的水化物的酸性A>B
C.单质D与AC2可以发生置换反应得到DC
D.B与C只能形成BC和BC2两种化合物
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (10分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ??,B?,C?,D?,E?
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
?。
(3)写出A、B两元素相互反应的化学方程式:
??。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
?。
参考答案:(1)A? Na,? B Al,? C? Si,? D P ,? E Cl
(2)?。
(3)? Al(OH)3+NaOH=NaAlO2+2H2O。
(4)? H3PO4>H2SiO3。
本题解析:
 已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al?
已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al?
根据是原子序数依次增大的短周期元素?
A 就是Na?
E就是Cl
B就为Al
C元素的最外层电子数比次外层电子数少4?即Si
D元素原子次外层电子数比最外层电子数多3?即P
(1) 见上
(2) 
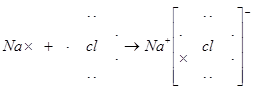
(3) Al(OH)3+NaOH=NaAlO2+2H2O
(4) 根据元素周期律?同周期元素的非金属性逐渐增强?酸性增强
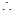 ? H3PO4>H2SiO3
? H3PO4>H2SiO3
本题难度:一般
5、选择题 下列叙述中,正确的是(?)
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.原子最外层电子数为2的元素一定处于周期表IIA族
C.离子化合物中可能含有共价键,但共价化合物中一定不含离子键
D.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
参考答案:C
本题解析:两种微粒,若核外电子排布完全相同,则其化学性质不一定相同,例如Na+和F-;原子最外层电子数为2的元素可以是He或者是副族、第Ⅷ族元素;离子化合物中可能含有共价键,例如NaOH,但共价化合物中一定不含离子键;单原子形成的离子,一定具有稀有气体元素原子的核外电子排布,例如Fe2+、H+等。所以正确的答案是C。
本题难度:简单