1、选择题 若发现117号元素X,则下列叙述正确的是(?)
A.X可以形成钠盐,其化学式为NaX
B.X的最高价氧化物的水化物是强酸
C.X的最高价氧化物的化学式为X2O7
D.X的单质为双原子分子
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列元素一定是主族元素的是(?)
A.原子核外N电子层上只有一个电子的元素
B.原子核外M层电子数为偶数的元素
C.原子核外M层电子数为奇数的元素
D.原子核外N层电子数为2的元素
参考答案:C
本题解析:原子核外N电子层上只有一个电子的元素可能是主族元素如K,也可能不是主族元素如Cu和Cr,所以A错;原子核外M层电子为偶数,则M层电子数可能为2、4、6、8,可能为0族元素,不一定是主族元素,所以B错;而原子核外M层电子数为奇数,说明该元素原子的M层即为最外层,其电子数可能为1、3、5、7,最外层电子数等于主族序数,所以C正确;原子核外N层电子数为2的元素可能是主族元素如Ca,也可能不是主族元素如Zn,所以D错。
本题难度:一般
3、选择题 下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是
①微粒半径:S2->Cl->Cl>S ?②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-?④氧化性:Cl2>S>Se
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥得电子能力:F>Cl>Br>I
A.只有①
B.②④⑥
C.①③④
D.只有⑥
参考答案:B
本题解析:根据元素周期律可知,①不正确,微粒半径应该是S2->Cl- >S>Cl;非金属性越强,氢化物的稳定性越强,②正确;非金属性越强,相应阴离子的还原性越弱,③不正确,还原性应该是S2->I->Br->Cl-;非金属性越强,相应单质的氧化性越强,④正确;非金属性越强,最高价氧化物的水化物的酸性越强,⑤不正确,应该是HClO4>H2SO4> H2SeO4;同主族自上而下,非金属性逐渐减弱,⑥正确,答案选B。
点评:该题是高考中的高频题,属于中等难度的试题,试题综合性强,主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律知识解决实际问题有的能力,有助于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。
本题难度:一般
4、选择题 稀盐酸中混有少量硫酸,为了除去硫酸,可加入适量
A.铁屑
B.氯化钡溶液
C.硝酸银溶液
D.氢氧化钠溶液
参考答案:B
本题解析:分析:根据除杂质的原则:首先方法要可行,既要能除掉杂质,又不能和需要的物质反应,同时也不能添加新的杂质;另外,实验操作越简单越好.要除去盐酸中的硫酸,实质就是除硫酸根离子,可用含钡离子的溶液把硫酸根转化成沉淀,同时生成盐酸.
解答:A、铁屑和盐酸、硫酸都反应生成盐,不仅把盐酸也除掉了,还添加新的杂质,故A错误;
B、氯化钡能把硫酸转化成硫酸钡沉淀,同时得到盐酸,故B正确;
C、硝酸银能和盐酸反应,把盐酸也除掉了,故C错误;
D、氢氧化钠能同时和盐酸、硫酸反应,把盐酸也除掉了,故D错误.
故选B.
点评:本题考查了除杂试剂的选取,难度不大,在选择除杂质试剂时,所选试剂不能和原物质反应,原物质的质量不能减少,可以增加,据此分析即可.
本题难度:一般
5、填空题 X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,W是最常见的黑色金属之一。
(1)Z位于元素周期表中的位置是?,W3+的最外层电子排布式是______,X的氧化物XO2与H2O比较,熔点较高的是______ (填化学式)。
(2)加热条件下,Z的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Z的最髙价含氧酸,写出此反应的化学方程式?。.
(3)比较Y、W性质的活泼性?(用一个化学反应方程式表示)。
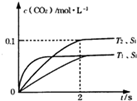
(4)2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5。汽车尾气净化的主要原理为:2NO(g)+2CO(g)  2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
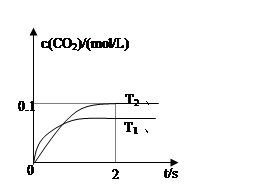
据此判断:
该反应为?反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)=?;
(5)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,
在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(6)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是?(填代号)。
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)
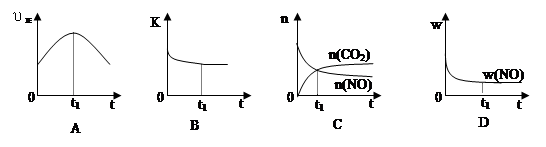
参考答案:(1)第三周期?ⅥA族? 3s23p63d5? H2O
(2)S+6HNO3(浓)  H2SO4+6NO2↑+2H2O。
H2SO4+6NO2↑+2H2O。
(3)Fe2O3 + 2Al 2Fe+Al2O3
2Fe+Al2O3
(4)放热? 0.025 mol/L·s
(5)
(6)B? D
本题解析:(1)X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X原子核外有两种形状的电子云,四种伸展方向,常温下以双原子分子存在,性质稳定,故X为N;Y的单质是生活中常见的合金材料成分之一,原子核外只有一个未成对电子,故Y为Al;Z原子的半径比X大,其基态原子最外层的p电子是该层s电子的两倍,故Z为S;W是最常见的黑色金属之一,故W为Fe;由上可知Z位于元素周期表中的位置是第三周期ⅥA族,W3+的最外层电子排布式是3s23p63d5,X的氧化物NO2与H2O比较,熔点较高的是H2O。
(2)化学方程式为:S+6HNO3(浓) H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
(3)置换反应可以反映金属的活泼程度,化学反应方程式为:Fe2O3 + 2Al 2Fe+Al2O3
2Fe+Al2O3
(4)由图可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应。由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=0.1mol/L/2s=0.05mol/(L?s),速率之比等于化学计量数之比,故v(N2)=1/2v(CO2)=1/2×0.05mol/(L?s)=0.025mol/(L?s)。
(5)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: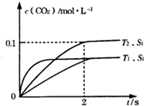 。
。
(6)A、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;B、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确。
本题难度:困难