1、选择题
已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为(?)
A.39:61
B.61:39
C.1:1
D.39:11
参考答案:答案:A
本题解析:
利用平均相对原子质量定义即可计算:
解法1?设铱的两种同位素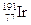 、
、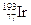 的原子数分别为
的原子数分别为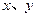 ,
,
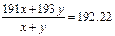 ?解得
?解得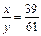
解法2
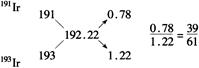
本题难度:一般
2、选择题 下表为短周期元素①~⑧的部分性质。
 元素编号 元素编号
元素性质
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径/10-10m
| 0.66
| 1.36
| 1.23
| 1.10
| 0.99
| 1.54
| 0.70
| 1.18
|
最高化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
| +3
|
最低化合价
| —2
| ?
| ?
| —3
| —1
| ?
| —3
| ?
|
下列说法正确的是?
A.元素④⑤形成的化合物是离子化合物
B.元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
C.元素①⑧形成的化合物具有两性
D.上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
参考答案:
BC
本题解析:略
本题难度:一般
3、选择题 已知下列元素的原子半径,根据表中数据推测磷原子的半径可能是
原子
| N
| S
| O
| Si
|
半径r/10-10m
| 0.75
| 1.02
| 0.74
| 1.17
|
A、0.80×10-10m? B、1.10×10-10m? C、1.20×10-10m? D、0.70×10-10m
参考答案:B
本题解析:磷的半径在硅和硫之间,1.02-------1.17,B正确。
本题难度:简单
4、选择题 四种短周期元素在元素周期表中的位置如右图所示,其中Z的原子半径最小。下列说法正确的是
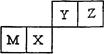
A.M元素一定为金属元素
B.X元素的最简单气态氢化物的热稳定性比Z元素的大
C.若Y元素存在最高价含氧酸,其酸性比X元素的最高价含氧酸弱
D.Z元素与氢元素一定能形成原子个数比为1︰1的共价化合物
参考答案:D
本题解析:A.若Z是F,则Y是O,X是P,M是Si,Si是非金属元素。错误。B.元素的非金属性越强,其对应的氢化物稳定性就越强。在元素周期表中同一周期的元素,从左到右,元素的非金属性逐渐增强;在同一主族中,从上到下,元素的非金属性逐渐减弱。所以非金属性Z>X,所以Z的氢化物稳定性比X的强。错误。C.同理非金属性Y>X,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。所以Y元素的最高价含氧酸的酸性比X元素的最高价含氧酸强。错误。D.由于Z的非金属性最强,为F,所以它与H形成原子个数比为1︰1的化合物HF为共价化合物。最强。
本题难度:一般
5、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
 周期 周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ⑧
| ⑨
| ?
|
 (1)9种元素中,原子半径最小的是?。
(1)9种元素中,原子半径最小的是?。
(2)④、⑤、⑥三种元素形成的简单离子中,离子半径最大的是?。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是__________________。
(4)元素③的氢化物的电子式为?;该氢化物常温下和⑨的氢化物两者反应的实验现象是?,上述反应得到一种盐,属于?化合物(填离子或共价)。检验该盐溶液中阳离子存在的方法是?
(5)⑤和⑧两元素可形成化合物,该化合物灼烧时火焰颜色为?色,用电子式表示该化合物的形成过程?。
(6)写出⑥的最高价氧化物与⑤的最高价氧化物对应水化物反应的离子方程式?。
 (7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
(7)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为____________(填序号)。
 ?A.MnO2 B.FeCl3 C.Na2SO3? D.KMnO4
?A.MnO2 B.FeCl3 C.Na2SO3? D.KMnO4
参考答案: (1)H?(2)O2-?(3)HNO3>H2CO3>H2SIO3
(1)H?(2)O2-?(3)HNO3>H2CO3>H2SIO3
(4)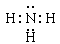 , 产生白烟,离子。取适量的该盐溶液放于试管中,加入浓氢氧化钠少量并
, 产生白烟,离子。取适量的该盐溶液放于试管中,加入浓氢氧化钠少量并
加热,用湿润的红色的石蕊试纸检验生成的气体,试纸变蓝,说明存在NH4+。
(5)黄色, 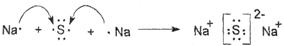
(6)Al2O3 + 2OH- ==2AlO2- + H2O ?(7)A B
?(7)A B
本题解析:根据元素在周期表中的相对位置可知,元素①~⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)9种元素中,原子半径最小的是H。
(2)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则④、⑤、⑥三种元素形成的简单离子中,离子半径最大的是O2-。
(3)非金属性越强,最高价氧化物的水化物的酸性越强,所以②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SIO3。
(4)元素③的氢化物是氨气,属于共价化合物,其电子式为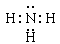 。氨气和氯化氢反应生成离子化合物氯化铵,现象是产生白烟。NH4+检验的方法是取适量的该盐溶液放于试管中,加入浓氢氧化钠少量并加热,用湿润的红色的石蕊试纸检验生成的气体,试纸变蓝,说明存在NH4+。
。氨气和氯化氢反应生成离子化合物氯化铵,现象是产生白烟。NH4+检验的方法是取适量的该盐溶液放于试管中,加入浓氢氧化钠少量并加热,用湿润的红色的石蕊试纸检验生成的气体,试纸变蓝,说明存在NH4+。
(5)⑤和⑧两元素形成化合物是硫化钠,该化合物灼烧时火焰颜色为黄色,其形成过程是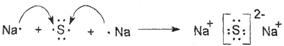 。
。
(6)⑥的最高价氧化物氧化铝是两性氧化物,与⑤的最高价氧化物对应水化物反应的离子方程式是Al2O3 + 2OH- ==2AlO2- + H2O 。
。
(7)表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,该化合物应该是双氧水,可以用二氧化锰和氯化铁做催化剂,答案选AB。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般