1、选择题 下列各组无机酸的酸性强弱比较正确的是
A.HClO>HClO2>HClO3>HClO4
B.HF<HCl<HBr<HI
C.H2CO3<H2SiO3<H2GeO3
D.HNO3<HPO3
参考答案:B
本题解析:略
本题难度:简单
2、填空题 【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式?。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为?。
参考答案:(1)1s22s22p63s23p63d104s24p3 ?N>O>B
(2)N原子和B原子采用不同的杂化形式?平面三角形
(3)sp3?共价键
(4)3NaN3=Na3N+N2↑?1:2
本题解析:(1)根据构造原理可知,As元素的基态原子核外电子排布式为1s22s22p63s23p63d104s24p3。非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,温度下强,所以氮元素的第一电离能大于氧元素的,即N>O>B。
(2)BF3分子中B原子没有孤对电子,是sp2杂化,分子结构是平面三角形。NF3分子中N原子含有1对孤对电子,是sp3杂化,分子结构是三角锥形结构。
(3)BN的晶体结构与金刚石相似,则B原子的杂化方式为sp3杂化,微粒间存在的作用力是共价键。
(4)①根据原子守恒可知,A应该是Na3N,所以反应的方程式是3NaN3=Na3N+N2↑。
③氮气中σ键是普轨道“头碰头”重叠形成的,π键是p轨道“肩并肩”重叠形成的。所以根据氮原子的核外电子排布可知,N2分子中存在的σ键和π键数目之比为1:2。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题在注重对基础知识巩固和训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、选择题 下列关于元素性质的有关叙述中不正确的是
A、C、N、O、F的原子半径依次减小
B、Na、K、Rb、Cs的失电子能力逐渐增强
C、C、N、O、F的最高正价依次升高
D、Na、Mg、Al、Si的最外层电子数依次增加
参考答案:C
本题解析:考查元素周期律的应用。同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族自上而下金属性逐渐增强,非金属性逐渐减弱,所以选项A、B、D均正确。氟是最强的非金属,没有正价,选项C是错误的,答案选C。
本题难度:一般
4、选择题 下列说法中肯定错误的是
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某原子M层上和L层上的电子数均为K层上的4倍
D.某原子的核电荷数与最外层电子数相等
参考答案:B
本题解析:某原子M层上电子数为L层上电子数的4倍为32超过了所能容纳的电子数。B错误。
本题难度:一般
5、选择题 X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一。下列有关判断中,正确的是?
A.X元素在周期表中的位置只能是第二周期第ⅣA族
B.若X的常见简单阴离子X 能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强
能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强
C.若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少
D.若X能形成XO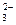 、XO
、XO 和X2O
和X2O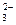 ,Y能形成YO
,Y能形成YO 和XO
和XO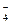 ,则X、Y一定在同一周期
,则X、Y一定在同一周期
参考答案:BD
本题解析:根据题意,符合条件的X可能为6C或16S。X元素在周期表中的位置可能是第二周期第ⅣA族,也可能是第三周期第ⅥA族。A错;Y的非金属性比它强时,一个原子所得电子不一定比它少(如:N原子得电子比S原子多,O原子与S原子同),C错。
本题难度:一般