1、填空题 (10分)甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
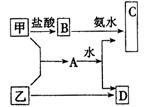
(1)若D为酸性气体,则元素符号:甲_______________乙_______________;
A与水反应的化学方程式为____________________________________________.
(2)若D为碱性气体,则元素名称:甲_______________乙_______________;
A与水反应的化学方程式为____________________________________________.
参考答案:(1)Al S 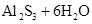

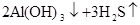
(2)氮 镁 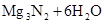

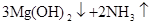
本题解析:两种短周期元素形成的化合物,溶于水能产生沉淀和气体的,可以是Al2S3或Mg3N2。所以如果D为酸性气体,则D是SO2,则甲是铝,乙是S,A是Al2S3,B是氯化铝,C是氢氧化铝;如果D是碱性气体,则D是氨气,则甲是镁,乙是氮气,A是Mg3N2,B是氯化镁,C是氢氧化镁。
本题难度:一般
2、填空题 .(12分)在下图转化关系中,固体甲的焰色反应呈黄色,M为常见的液体物质,I为常见金属,且I与G的稀溶液不反应,只能与G的浓溶液在加热条件下反应;酸G是重要的化工产品和化工原料;H为良好的耐火材料(图中部分产物没有列出)。
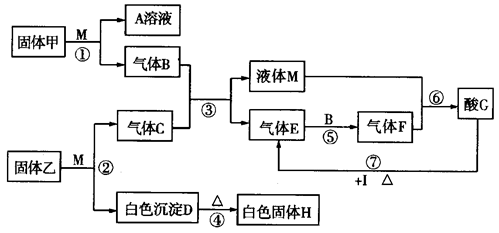
(1)固体甲的名称为__________,F的化学式为______________。
(2)反应①~⑦中属于氧化还原反应的是______________(填写反应序号)。
(3)工业废气中常含有气体E,为了充分利用资源、保护环境,目前应用最广泛的工业废气处理方法是石灰法。以生石灰为原料在吸收装置中与气体E反应的化学方程式为:
___________________________________________。
(4)反应⑦的化学反应方程式为_____________________________________________。
(5)已知工业上电解熔融的H冶炼金属单质X,向40.0g固体混合物中(仅含H、Fe2O3、SiO2),加入足量稀盐酸,分离得到12.0g固体;滤液中加入过量A溶液,分离得到21.4g固体;则此混合物中元素X的质量分数为__________________。
参考答案:

本题解析:本题为元素及化合物的推断题,在解题中要充分分析题目所给的信息,找出突破口。(1)固体甲为焰色为黄色,故为钠及其化合物;(2)M为液体,在中学的物质中溶液很多,但液体不多,可以推测为水、硫酸等;(3)气体C气体E气体F,这个过程可能为连续氧化,推测可能为S、N等,又因为金属I与酸G,在加热的条件下反应,不是HNO3,而应该为H2SO4,从而确定C为H2S;(4)固体乙与M的反应为水解反应,故乙为金属硫化物,又从H为防火材料,电解熔融物得到金属单质,可确定为Al。
本题难度:一般
3、填空题 (11分)A、B、C、D、E为元素周期表中前三周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8.
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为________________乙与甲的水溶液反应的离子方程式为_______________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,该反应的化学方程式为? ______________________
(3)有一种液态氮氢化合物戊,分子中氮与氢两种元素的质量比为7∶1,与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为_____________,1 mol戊与过量盐酸反应的离子方程式是? ______________ 91exam .org__________?戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是_______________________________________________________________;8 g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375 kJ的热量,写出该反应的热化学方程式
________________________________________________________________
参考答案:(1)第三周期第ⅢA族? Al(OH)3+OH-===AlO+2H2O
(2)2Na2O 2+2H2O===4NaOH+O2↑
2+2H2O===4NaOH+O2↑
(3)?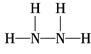 ? ? N2H4+2H+===N2H
? ? N2H4+2H+===N2H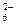 戊中氮元素的化合价为-2价,既可以升高,又可以降低
戊中氮元素的化合价为-2价,既可以升高,又可以降低
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g)ΔH=-1 500 kJ/mo
本题解析:略
本题难度:简单
4、填空题 (8分)下图中各物质均为中学化学中常见的物质,它们之间有如图转化关系。其中A、C均为金属单质;D的焰色反应呈黄色;C与水反应除了生成D,还能生成自然界最轻的气体;E是一种氢氧化物,它既能跟NaOH反应又能跟盐酸反应。(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)B是_________,E是_________。(填化学式)
(2)写出E转化为G的离子方程式?。
(3)写出C和水反应的化学方程式??。
参考答案:
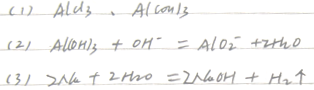
本题解析:略
本题难度:一般
5、填空题 A、B、C、D、E是中学常见的几种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
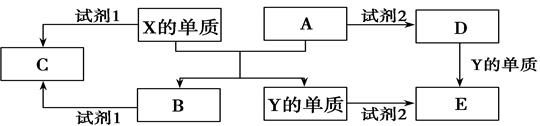
回答下列问题:
(1)X的单质与A反应的化学方程式是________________________________。
(2)若C溶液显碱性,则试剂1是? ____溶液(写化学式);若C溶液显酸性,则显酸性的原因是(用离子方程式表示)?。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是?;
②写出D→E反应的离子方程式?;
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是:?。
参考答案:(1)2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
(2)NaOH(或OH-) Al3++3H2O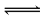 Al(OH)3+3H+
Al(OH)3+3H+
(3)①取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色;则证明原溶液含有Fe3+
②2Fe3++Fe=3Fe2+?③2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
本题解析:元素X、Y的单质是生活中常见的金属,Y的用量最大,则X为Al,Y为Fe,A、B是氧化物,则Al与氧化铁反应生成Fe和氧化铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,若C溶液显碱性,则试剂1为NaOH溶液时,C为偏铝酸钠;若C溶液为酸性,C为强酸对应的铝盐,试剂2为硫酸时,D为硫酸铁、E为硫酸亚铁;试剂1为硫酸时,C为硫酸铝,该溶液水解显酸性,
(1)X的单质与A反应为铝热反应,即Al与氧化铁反应生成氧化铝和Fe,该反应为Fe2O3+2Al
Al2O3+2Fe,
(2)若C溶液为碱性,试剂1是NaOH溶液,①Al与NaOH溶液反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;若C溶液显酸性,则显酸性的原因是Al3++3H2O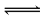 Al(OH)3+3H+
Al(OH)3+3H+
(3)若试剂1和试剂2均是稀硫酸,
①D为硫酸铁,检验铁离子的方法为取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+,
故答案为:取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+;
②写出D→E反应的离子方程式2Fe3++Fe=3Fe2+;
③E为硫酸亚铁,与稀硫酸和亚硝酸钠为原料生成Fe(OH)SO4,反应中有NO生成,该反应为2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
本题难度:一般