1、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;?X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
参考答案:由Y的单质晶体熔点高、硬度大,是一种重要的半导体材料可知Y是硅元素,即X、Y、Z、W属于第三周期,由离子半径:Z2->W-可知X、Z、W分别属于钠、硫、氯元素,又因为Z、M同主族且X+与M2-具有相同的电子层结构,则M是氧元素;
A、因钠和氧还可以形成Na2O2,故A错误;
B、因水分子中存在氢键,所以水的沸点最高,沸点为H2O>HCl>H2S,故B错误;
C、元素Y、Z、W的单质晶体分别属于原子晶体、分子晶体、分子晶体,故C错误;
D、Cl2和O3都具有强氧化性,则可以作为消毒剂,故D正确;
故选:D.
本题解析:
本题难度:简单
2、填空题 26.(15分)2011年9月29日21时天宫一号在酒泉卫星发射中心发射成功,标志着中国航天迈入了新的台阶,火箭推进剂是成功发射火箭的重要因素。推进剂主要由可燃剂和氧化剂组成,根据化学物质的形态不同推进剂可分为固体推进剂和液体推进剂,它们一般由C、H、O、N中的一种或几种元素组成。请回答下列问题:
(1)已知某固体推进剂主要由可燃剂(聚丁二烯等)和氧化剂甲(一种由三种元素组成的盐)组成,该盐溶液中加入硝酸银溶液,无明显现象,则甲物质所含的化学键类型?,并用离子方程式表示甲的水溶液呈酸性的原因?。
(2)已知某液体推进剂主要由可燃剂肼(N2H4)和氧化剂乙组成,乙所含有的电子数和肼分子相同,常温下,乙和肼反应生成一种常见的液态化合物和一种常见的稳定单质,试写出该反应的化学方程式?。列举乙的另一种主要用途?。
A.石油产品? B.四氯化碳? C.液氟?D.纯碱
(4)戊也可作液体推进剂的氧化剂,取19.6g化合物戊,隔绝空气加热使其完全分解,生成氮气、氧气和二氧化碳,生成的氮气折合成标准状况下的体积为4.48L,生成的二氧化碳气体被足量的澄清石灰水吸收,得到10.0 g沉淀,生成的氧气折合成标准状况下的体积为?L;戊的化学式为? ??。
(5)请设计一个实验方案,探究由上述四种元素组成的常见无机盐可能的成份。
__________________________________________
参考答案:(1)离子键、共价键(各1分共2分), NH4++H2O H++NH3·H2O(1分)
H++NH3·H2O(1分)
(2)N2H4 +2H2O2=N2 +4 H2O(2分);杀菌、消毒、漂白(1分,合理都给分)
(3)A、C(2分)?
(4)6.72 (2分), C(NO2)4(写成CN4O8也给分,2分)
(5)无机盐可能是(NH4)2CO3或NH4HCO3或两者的混合物(1分),称量固体样品的质量mg,将样品加热,并将气体通入足量的澄清石灰水,测出沉淀的质量ng,通过m与n的计算获得最终结果。(2分)(其它合理答案也给分)
本题解析:(1)盐溶液中加入硝酸银溶液,无明显现象,说明是铵盐,所以含有离子键和极性键。铵盐水解显酸性,方程式为NH4++H2O H++NH3·H2O。
H++NH3·H2O。
(2)肼分子含有的电子数是18,所以氧化剂是双氧水,方程式为N2H4 +2H2O2=N2 +4 H2O,双氧水的主要用途是杀菌、消毒、漂白等。
(3)推进剂主要由可燃剂和氧化剂组成,所以应该选择AC。
(4)氮气是0.2mol,质量是5.6g。CO2是0.1mol,质量是4.4g,根据质量守恒定律可知氧气的质量是19.6g-5.6g-4.4g=9.6g,物质的量是0.3mol,所以体积是6.72L。则分子中C、N、O的原子个数之比是1︰4︰8,所以化学式为C(NO2)4。
(5)该无机盐是碳酸铵或碳酸氢铵或是二者的混合物。而者都易分解,所以可以通过分解产物的质量多少来判断。例如称量固体样品的质量mg,将样品加热,并将气体通入足量的澄清石灰水,测出沉淀的质量ng,通过m与n的计算获得最终结果。
本题难度:一般
3、选择题 下列化学用语正确的是( )
A.氮分子的电子式:

B.硫原子的结构示意图:
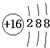
C.溴化钠的电子式:

D.水分子的结构式:
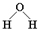
参考答案:D
本题解析:
本题难度:一般
4、填空题 (11分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:回答下列问题:
元素编号
| 元素特征信息
|
A
| 其单质是密度最小的物质
|
B
| 阴离子带两个单位负电荷,单质是空气的主要成分之一
|
C
| 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物
|
D
| 其氢氧化物和氧化物都有两性,与C同周期
|
E
| 与C同周期,原子半径在该周期最小
|
(1)写出下列元素的名称:C________,E________;
(2)写出A、B、C形成的化合物M的电子式________;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________;
(4)D单质与M的水溶液反应的离子方程式:________
参考答案:(1)钠 氯 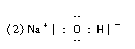 (3)共价键
(3)共价键
本题解析:考查了元素推断知识,对化学用语的书写主要是细心。
由题给条件可推得A、B、C、D、E五种短周期元素分别为:H、O、Na、Al、Cl;
(3)AlCl3虽然是由活泼的金属与非金属形成的化合物,但其在熔融状态下不导电,说明原子之间并不是离子键。
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题难度:一般
5、选择题 下列叙述正确的是?(?)
A.3Li+中含有的中子数与电子数之比为4∶3
B.离子化合物中只含有离子键
C.常温下,11.2L的甲烷气体中含有碳氢键的物质的量为2mol
D.常温下,可用铁制的容器来盛装浓硝酸或浓硫酸
参考答案:D
本题解析:略
本题难度:简单