1、选择题 下列各项中表达正确的是( )
A.F-的结构示意图: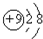
B.NH4Cl的电子式: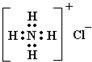
C.NaCl的电子式: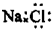
D.乙烯的结构简式:CH2CH2
2、选择题 下列物质中,属于含有非极性键的共价化合物的是
[? ]
A.N2
B.Na2O2
C.C2H4(乙烯)?
D.CH4
3、选择题 BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是
A.分子中各原子最外层都满足8电子稳定结构
B.键角均为60°,都是含有极性键的极性分子
C.BF3沸点低于BCl3沸点,因为B-F键键长短
D.BF3分子稳定性高于BCl3,因为B-F键键能高
4、选择题 下列说法中不正确的是
[? ]
A.σ键的电子云分布对键轴方向呈圆柱形对称
B.π键的电子云分布是对通过键轴的平面呈镜面对称
C.σ键比π键活泼性高,易参与化学反应
D.成键电子的原子轨道重叠程度越大,所形成的共价键越牢固
5、填空题 研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
电离能/(kJ·mol-1)
| I1
| I2
| I3
| I4
|
A
| 932
| 1 821
| 15 390
| 21 771
|
B
| 738
| 1 451
| 7 733
| 10 540
|
?
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,d0或d10排布无颜色,d1~d9排布有颜色。如[Co(H2O)6]2+显粉红色。据此判断:[Mn(H2O)6]2+________(填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为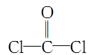 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g)。反应过程中,断裂的化学键只有配位键,则形成的化学键类型是________。