1、填空题 (6分)(1)(2分)用水稀释0.1mol/L氨水,溶液中随着水量的增加而减小的是_______(填字母)

(2)(4分)已知25℃时,Ksp(CaSO4)==7.10×10-5.向0.100L含CaSO4固体的溶液中加入2.22gCaCl2粉末充分搅拌,若溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将______ (填“增大”、“减小”或“不变”,下同), Ksp(CaSO 4)将________。
4)将________。
参考答案:(1)BD? (2) 增大?不变
本题解析:略
本题难度:一般
2、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L?0.2mol?L-1HF溶液中加入1L?0.2mol?L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1mol?L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.加入CaCl2溶液后体系中的c(H+)浓度不变
D.该体系中有CaF2沉淀产生
参考答案:A.电离常数Ka(HF)=3.6×10-4,HF为弱电解质,不能完全电离,25℃时,0.1mol?L-1HF溶液中c(H+)=
本题解析:
本题难度:一般
3、选择题 在一定条件下,Na2CO3溶液存在水解平衡: CO32-+H2O HCO3-+OH-,下列说法正确的是(?)
HCO3-+OH-,下列说法正确的是(?)
A.稀释溶液,水解平衡常数增大
B.加入NaOH固体,c(HCO3-)/c(CO32-) 减少
C.升高温度,平衡常数减小
D.通入CO2,pH增大
参考答案:B
本题解析:稀释溶液,由于温度不变,水解平衡常数仍然不变,故A错误;加入NaOH固体,使得 CO32-+H2O HCO3-+OH-向左移动,所以c(HCO3-)/c(CO32-) 减少,故B正确,为本题的答案;水解过程是吸热过程,所以升高温度,平衡常数增大,故C错误;通入CO2,pH减小,所以D错误。
HCO3-+OH-向左移动,所以c(HCO3-)/c(CO32-) 减少,故B正确,为本题的答案;水解过程是吸热过程,所以升高温度,平衡常数增大,故C错误;通入CO2,pH减小,所以D错误。
点评:本题考查了水解平衡,该考点是高考考查的热点,本题要注意水解过程是吸热过程,并且水解常数只于物质的性质和温度有关。
本题难度:简单
4、选择题 在Ca(OH)2(Ksp=5.5×10-6)、Mg(OH)2(Ksp=1.2×10-11)、AgCl(Ksp=1.56×10-10)三种物质中,下列说法正确的是
[ ? ]
A.Mg(OH)2的溶解度最大
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同条件下Ksp越大的溶解度也越大
参考答案:D
本题解析:
本题难度:一般
5、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(?)
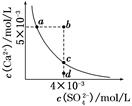
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般