1、填空题 (12分)水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式: ;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥ ;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。
参考答案:(1)Al3++3NH3?H2O=Al(OH)3↓+3NH4+ (2) 5 (3) 60.7%
本题解析:(1)稀氨水能与Al3+反应生成氢氧化铝沉淀和铵根离子:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)欲使溶液中c(Al3+)≤l.0×l0-6mol?L-1,C(OH-)≥ =
= =l.0×l0-9mol?L-1,
=l.0×l0-9mol?L-1,
c(H+)≥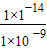 mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
(3)5CaO~ 5CaC2O4 ~ 2KMnO4
5×56g 2mol
m(CaO) 0.1000mol?L-1×0.013L
 解得:m(CaO)=0.182g,氧化钙的质量分数为:
解得:m(CaO)=0.182g,氧化钙的质量分数为: ×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
考点:考查沉淀溶解平衡的计算,利用化学方程式的计算等知识。
本题难度:困难
2、选择题 硫酸钡用作钡餐的理由是:①既不溶于水,也不溶于酸? ②不易被X射线透过? ③对肠胃基本无害
A.①②③
B.只有①
C.只有②
D.只有②③
参考答案:A
本题解析:根据硫酸钡的性质,以及对人体健康的关系分析可知,选项①②③都是正确的,答案选A。
点评:该题是常识性知识的考查,难度不大。试题贴近生活,有利于调动学生的学习兴趣和学习化学的积极性。
本题难度:简单
3、选择题 向 溶液中加入过量难溶电解质
溶液中加入过量难溶电解质 ,可使溶液中含有的
,可使溶液中含有的 、
、 、
、 等金属离子转化为硫化物沉淀,从而得到纯净的
等金属离子转化为硫化物沉淀,从而得到纯净的 。下列分析正确的是
。下列分析正确的是
A. 具有吸附性
具有吸附性
B. 有还原性,将
有还原性,将 还原后除去
还原后除去
C. 溶液度大于
溶液度大于 、
、 、
、
D. 与
与 反应的离子方程式是
反应的离子方程式是