1、选择题 下列措施中,能加快化学反应速率的是
A.将食物储存在冰箱里
B.在稀H2SO4与NaOH溶液反应时,增大压强
C.往H2O2溶液中加入几滴FeCl3溶液
D.用18mol/L H2SO4溶液代替1 mol/L H2SO4溶液与铁反应
参考答案:C
本题解析:在其它条件不变的情况下,升高温度或增大反应物的接触面积或使用催化剂等均可以加快反应速率,据此可知选项C能加快反应速率。A中降低反应速率,B中压强对反应速率的影响不能适用于液体,D中浓硫酸和铁在常温下发生钝化,答案选C。
点评:该题是中等难度的试题,主要是考查学生对外界条件是如何影响反应速率的了解掌握情况,意在培养学生的逻辑推理能力,提高学生的应试能力。该题需要注意的是压强对反应速率的影响适用范围。
本题难度:一般
2、选择题 镁粉与一定量盐酸反应时,速率太快,为了减缓反应速率又不影响产生氢气的总量,可以加入的物质是( )
A.H2O
B.Na2CO3
C.NaOH
D.CH3COONa
参考答案:根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A、加入水,氢离子的浓度减小,但氢离子的物质的量没有变化,则反应速率减慢,但又不影响产生氢气的总量,故A正确;
B、加入Na2CO3固体,与盐酸反应生成二氧化碳,减少氢气的生成,故B错误;
C、加入NaOH,发生酸碱中和反应,减少氢气的生成,故C错误;
D、加入CH3COONa,与盐酸反应生成醋酸,氢离子浓度减小而不改变氢原子子的总物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,故D正确;
故选AD.
本题解析:
本题难度:一般
3、选择题 反应A(g)+3B(g)===2C(g)+2D(g),在四种不同的情况下的反应速率分别为:
①v(A)=0.2mol·(L·s)-1 ②v(B)=0.6mol·(L·s)-1 ③v(C)=0.3mol·(L·s)-1 ④v(D)=0.5 mol·(L·s)-1该反应进行最快的是
A.① B.② C.③ D.④
参考答案:D
本题解析:同一个化学反应,用不同的物质表示其反应速率时,速率数值可能不同,但表示的意义是相同的,所以比较反应速率快慢时,应该根据速率之比是相应的化学计量数之比先换算成用同一种物质表示,然后才能直接比较速率数值。因此如果都用B表示反应速率,则分别为0.6mol·(L·s)-1、0.6mol·(L·s)-1、0.45mol·(L·s)-1、0.75mol·(L·s)-1,所以答案选D。
本题难度:一般
4、选择题 设C+CO2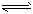 2CO(吸热反应)反应速率为v1,N2+3H2
2CO(吸热反应)反应速率为v1,N2+3H2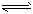 2NH3(放热反应)反应速率为v2。对于上述反应,升高温度时,v1和v2的变化情况为
2NH3(放热反应)反应速率为v2。对于上述反应,升高温度时,v1和v2的变化情况为
[? ]
A.都增大
B.都减小
C.v1增大,v2减小
D.v1减小,v2增大
参考答案:A
本题解析:
本题难度:简单
5、选择题 在2L密闭容器内,按物质的量之比为2:1投入NO?和O2.某温度下发生如下反应:2NO(g)+O2(g)?2NO2(g),n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5
n(NO)(mol)
0.020
0.015
0.012
0.010
0.010
0.010
|
下列说法不正确的是( )
A.在0~2s内,v(O2)=0.002mol?L-1?s-1
B.在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大
C.5s后向容器中通入0.02mol?NO2,再次平衡后,0.020mol<n(NO2)<0.040mol
D.5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动
参考答案:A、化学反应速率v(NO)=△c△t=-0.012mol-0.020mol2L2s=0.002mol?L-1?s-1,根据化学反应速率之比等于系数值比,所以v(O2)=0.001mol?L-1?s-1,故A错误;
B、向容器中加入O2,平衡将正向移动,但是化学平衡常数数温度的函数,温度没变,所以平衡常数不变,故B错误;
C、向容器中通入0.02mol?NO2,相当于增大了体系的压强,会引起化学平衡向正向移动,再次平衡后,0.020mol<n(NO2)<0.040mol,故C正确;
D、5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,相当于在化学平衡体系中增大压强,2NO(g)+O2(g)?2NO2(g)平衡会向着正方向发生移动,故D正确.
故选AB.
本题解析:
本题难度:一般