1、填空题 (9分)亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
Na2SO3+KIO3+H2SO4 ==Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是?,若反应中有5mol电子转移,则生成碘是________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)?②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快)?④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由?步反应决定。
参考答案:(1)KIO3;0.5(2)①
本题解析:(1)根据方程式可知,碘酸钾中碘元素的化合价从+5价降低到0价,得到5个电子,所以碘酸钾是氧化剂;如果转移5mol电子,则生成碘单质是0.5mol。
(2)根据反应过程和机理可知,该反应的反应速率决定于反应速率最慢的那一步,所以答案选①.
本题难度:一般
2、选择题 如图表示反应2SO2(g)+O2(g) 2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )
2SO3(g) ΔH<0的正反应速率随时间的变化情况,试根据此曲线判断说法可能正确的是( )
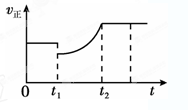
A.t1时降低温度,平衡向正反应方向移动
B.t1 时减小压强,平衡向逆反应方向移动
C.t1时减小SO2的浓度,增加了SO3的浓度
D.t1时增加SO2和O2的浓度,平衡向正反应方向移动
参考答案:C
本题解析:正反应是放热反应,所以降低温度平衡向正反应方向进行,则正反应速率降低后,在逐渐降低,A不正确;降低压强,平衡向逆反应方向进行,但最终平衡时,正反应速率不可能大于原来的正反应速率,选项C不正确;减小SO2的浓度,增加了SO3的浓度,则平衡向逆反应方向进行,正反应速率先是降低,任何逐渐增大,选项C正确;增加SO2和O2的浓度,正反应速率是增大的,选项D不正确,答案选C。
本题难度:一般
3、选择题 一定条件下,可逆反应C(s)+CO2(g)  ?2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
?2CO(g) ΔH<0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积:④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④
B.①③
C.②④
D.①③④
参考答案:B
本题解析:①升高反应体系的温度,反应速率加快,正确;②C为固体,增加反应物C的用量,对反应速率无影响,错误;③缩小反应体系的体积,反应速率加快,正确:④减少体系中CO的量,再次达平衡后,反应速率减慢,错误;综上所述,选B。
本题难度:一般
4、填空题 (9分)(1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率 ,充分反应后产生氢气的量 (相同、醋酸的多、盐酸的多),原因是 。
(2)在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入 晶体,理由是 ;要使产生氢气的量不变,但反应速率减慢,可加入 晶体,理由是 。
可供选择的晶体有:
A.纯碱
B.烧碱
C.胆矾
D.醋酸钠 E.KHSO4