1、计算题 (12分)在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
⑴求20℃时,该反应的平衡常数K(保留三位有效数字)
⑵20℃时,若在同一容器中加入1molA、??mol B和??mol C,则平衡混合气中C的体积分数仍为ω。
参考答案:⑴ 0.0893?⑵4molB? 2mol C
本题解析:(1)在反应达到平衡时由于产生C1.2mol,根据方程式可知消耗的A、B的物质的量分别是0.6mol、1.2mol。因此平衡时各种物质的浓度是:c(A)=(2-0.6)mol÷2L=0.7mol/L;c(B)=(6-1.2)mol÷2L=2.4mol/L;c(A)=1.2mol÷2L=0.6mol/L。因此20℃时,该反应的平衡常数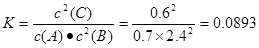 。⑵在恒温恒容条件下,对于反应前后气体体积不同的可逆反应,若一边倒转化后气体的物质的量相同,则平衡时等效。平衡混合气中C的体积分数仍为ω。假设要加入B、C的物质的量分别是x、y.可以认为ymol的C不是加入的而是反应消耗A、B产生的,则根据方程式中的关系可知反应消耗A:y/2mol;B:ymol。则开始时加入的A为(1+ y/2)mol;加入的B为(x+ y)mol。所以1+ y/2=2;x+ y=6.解得x=4;y=2..即开始时加入1mol的A;4molB;2mol的C。
。⑵在恒温恒容条件下,对于反应前后气体体积不同的可逆反应,若一边倒转化后气体的物质的量相同,则平衡时等效。平衡混合气中C的体积分数仍为ω。假设要加入B、C的物质的量分别是x、y.可以认为ymol的C不是加入的而是反应消耗A、B产生的,则根据方程式中的关系可知反应消耗A:y/2mol;B:ymol。则开始时加入的A为(1+ y/2)mol;加入的B为(x+ y)mol。所以1+ y/2=2;x+ y=6.解得x=4;y=2..即开始时加入1mol的A;4molB;2mol的C。
本题难度:一般
2、选择题 对可逆反应4NH3(g) + 5O2(g) 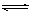 ?4NO(g) + 6H2O(g),下列叙述正确的是
?4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减小,平衡正向移动
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)
参考答案:A
本题解析:A、4v正(O2)=5v逆(NO),不同物质表示正逆反应速率之比等于化学计量数之比,表示反应达到平衡状态,故A正确;B、若单位时间内生成xmolNO的同时,消耗xmolNH3,都表示向反应正向进行,反应自始至终都是1:1,不能说明到达平衡,故B错误;C、达到化学平衡时,若增加容器体积,则物质的浓度减小,正逆反应速率均减小,平衡向正反应移动,故C错误;D、化学反应速率关系是:3υ正(NH3)=2υ正(H2O),故D错误.故选A.
本题难度:一般
3、填空题 对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.
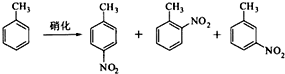
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h.反应结束后,过滤,滤液分别用5%?NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是______.
(2)滤液在分液漏斗中洗涤静置后,有机层处于______层(填“上”或"下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有______.
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%)
n(甲苯)
对硝基甲苯
邻硝基甲苯
间硝基甲苯
|
浓H2SO4
1.0
35.6
60.2
4.2
98.0
1.2
36.5
59.5
4.0
99.8
|
NaHSO4
0.15
44.6
55.1
0.3
98.9
0.25
46.3
52.8
0.9
99.9
0.32
47.9
51.8
0.3
99.9
0.36
45.2
54.2
0.6
99.9
|
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______.
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是______.
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有______、______.
参考答案:(1)NaHSO4在该反应中作为催化剂,因此反应后过滤的目的是为了回收NaHSO4,故答案为:回收NaHSO4;
(2)该反应是以CCl4 作为有机溶剂,CCl4的密度比水大,故有机层在下层;分液漏斗里的液体放不下来,除了分液漏斗堵塞,还有可能是分液漏斗上口活塞未打开,故答案为:下; 分液漏斗上口塞子未打开;
(3)①从题给数据分析,当催化剂与甲苯的比例为0.32时,总产率最高且对硝基甲苯的含量最高,故答案为:0.32;
②从题给数据可以看出,无论以何种比例反应,产物中的主要成分主要是对硝基甲苯和邻硝基甲苯,故答案为:甲苯硝化主要得到对硝基甲苯和邻硝基甲苯;
③用NaHSO4 做催化剂的优点是在硝化物中对硝基甲苯的比例提高、同时催化剂能循环使用.故答案为:在硝化产物中对硝基甲苯比例提高? 催化剂用量少且能循环使用.
本题解析:
本题难度:一般
4、选择题 被称为人体冷冻学之父的罗伯特·埃廷格(Robert Ettinger)在1962年写出《不朽的前景》(The Prospect Of Immortality)一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是
A.温度越低,化学反应越慢
B.低温下分子无法运动
C.温度降低,化学反应停止
D.化学反应前后质量守恒
参考答案:A
本题解析:冬天温度低,化学反应速率慢。春天温度逐渐升高,反应速率逐渐加快,据此可知选项A正确,答案选A。
点评:该题是设计新颖,有利于调动学生的学习兴趣,激发学生的学习求知欲。该题的关键是明确温度和反应速率的关系,然后结合题意灵活运用即可。
本题难度:简单
5、选择题 下列说法正确的是( )
A.活化分子每一次碰撞都能发生反应.
B.反应物用量增加有效碰撞次数增多反应速率增大.
C.有能量的分子叫活化分子.
D.当碰撞的分子具有足够能量和合适的取向,才能发生化学反应
参考答案:A.发生有效碰撞才反应,所以活化分子的碰撞不一定反应,还与取向有关,故A错误;
B.反应物为纯固体或液体,用量增加,反应速率不变,反应物用量增加不一定反应速率加快,故B错误;
C.任何分子都有能量,能发生有效碰撞的分子为活化分子,故C错误;
D.碰撞的分子具有足够能量和合适的取向,才能发生反应,故D正确;
故选D.
本题解析:
本题难度:简单