|
高中化学知识点大全《影响化学反应速率的因素》试题特训(2017年最新版)(六)
2017-11-11 01:12:15
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 对于反应 A + B 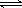 C,下列条件的改变一定能使化学反应加快的是 C,下列条件的改变一定能使化学反应加快的是
A.升高体系的温度
B.增加A的物质的量
C.减少C的物质的量
D.增大体系的压强
|
参考答案:A
本题解析:A.升高体系的温度,无论是放热反应,还是吸热反应,化学反应速率一定加快,正确;B.增加A的物质的量,若A的状态不是纯固体或纯液体,则化学反应速率能够加快,若是则速率不变,错误;C.减少C的物质的量若C的状态不是纯固体或纯液体,则化学反应速率能够加快,若是则速率不变,错误;D.增大体系的压强,若体系中有气体参加,则化学反应速率加快,否则无影响,错误。
考点:考查影响化学反应速率的因素的知识。
本题难度:一般
2、实验题 硫代硫酸钠(Na2S2O3)俗称大苏打,照相业中用作定影剂。Na2S2O3易溶于水,在酸性溶液中与酸反应有单质硫和SO2生成。
(1)Na2S2O3溶液与稀硫酸混合反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5 mL):
实验编号
| T/K
| c(Na2S2O3)/ mol·L-1
| c(H2SO4)/ mol·L-1
| 实验目的
| ①
| 298
| 0.1
| 0.1
| 实验①和②探究温度对该反应速率的影响;
实验①和③探究反应物浓度对该反应速率的影响
| ②
| 308
| ?
| ?
| ③
| ?
| 0.2
| ?
|
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为:
________??(提示:S元素被氧化为SO42-)。
(3)现有一瓶Na2S2O3固体,可能含有Na2SO4固体,请设计实验验证,写出实验步骤、预期现象和结论。限选试剂:1 mol·L-1 H2SO4、1 mol·L-1 HNO3、1 mol·L-1 HCl、1 mol·L-1 NaOH、0.1 mol·L-1 Ba(NO3)2、0.1 mol·L-1 BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
实验步骤
| 预期现象和结论
| 步骤1:取少量固体于试管A中,加蒸馏水溶解。
| ?
| 步骤2:向试管A加入?
?
| ?
?
| 步骤3:取步骤2的少量上层清液于试管B中,??
?
| ?
?
|
?
参考答案:(1)表格内每空1分,共4分
实验编号
T/K
c(Na2S2O3)/
mol·L-1
c(H2SO4)/
mol·L-1
①
?
?
?
②
?
0.1
0.1
③
298
?
0.1
(2) Na2S2O3+4Cl2+5H2O = Na2SO4+8HCl+H2SO4(2分,未配平给1分)(或Na2S2O3+4Cl2+5H2O = 2NaCl+6HCl+2H2SO4)
(3)
实验步骤
预期现象和结论
步骤1:取少量固体于试管中,加蒸馏水溶解
?
步骤2:向试管中加入过量1 mol·L-1 HCl溶液,充分振荡,静置(2分)
有淡黄色沉淀生成(2分)
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液(2分)
有白色沉淀生成,证明固体中混有Na2SO4(2分)
[或无白色沉淀生成,证明固体中无Na2SO4]
?
步骤2:步骤与现象、结论不株连。未写“过量”扣1分;缺少“充分振荡”扣一分。现象和结论中:刺激性气味气体或气泡产生可给分。
步骤3:无“少量”不扣分,将BaCl2写成Ba(NO3)2的不得分,不株连现象和结论
本题解析:(1)探究影响化学反应速率的因素时,每次只能改变一个条件,①和②温度不同,浓度应该相同,①和③改变了Na2S2O3的浓度,其他条件相同;(2)发生氧化还原反应,结合电子守恒配平;(3)
实验步骤
预期现象和结论
步骤1:取少量固体于试管中,加蒸馏水溶解
?
步骤2:向试管中加入过量1 mol·L-1 HCl溶液,充分振荡,静置(2分)
有淡黄色沉淀生成(2分)
步骤3:取上层清液于另一试管中,滴加少量0.1 mol·L-1BaCl2溶液(2分)
有白色沉淀生成,证明固体中混有Na2SO4(2分)
[或无白色沉淀生成,证明固体中无Na2SO4]
本题难度:一般
3、选择题 锌粒和盐酸反应一段时间后,反应速率减慢。此时加热或加入浓盐酸,反应速率明显加快。上述实验中影响化学反应速率的因素有:
[? ]
①温度 ②固体的表面积 ③反应物的状态 ④溶液的浓度 ⑤催化剂
A.①④
B.①③
C.②④
D.①②③④⑤
参考答案:A
本题解析:
本题难度:一般
4、选择题 二氧化氮存在下列平衡:2NO2(气)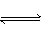 N2O4(气)(正反应为放热反应)在测定NO2的相对分子质量时,下列条件中较为适宜的是( ) N2O4(气)(正反应为放热反应)在测定NO2的相对分子质量时,下列条件中较为适宜的是( )
A.温度130℃、压强3.03×105Pa
B.温度25℃、压强1.01×105Pa
C.温度130℃、压强5.05×104Pa
D.温度0℃、压强5.05×104Pa
参考答案:C
本题解析:化学平衡:2NO2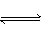 N2O4的正反应是气体体积减小的放热反应,温度较高,压强较低有利于平衡向逆反应方向移动,从而达到准确测定NO2的相对质量分子的目的。 N2O4的正反应是气体体积减小的放热反应,温度较高,压强较低有利于平衡向逆反应方向移动,从而达到准确测定NO2的相对质量分子的目的。
本题难度:简单
5、选择题 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)  2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是 2Z(g)+W(s),△H<0的反应过程。若使a曲线变为b曲线,可采用的措施是
 ? ?
A.增大体积
B.增大Y的浓度
C.降低温度
D.缩小体积
参考答案:D
本题解析:根据图像可知,a→b,X的转化率不变,但缩短了达到平衡的时间,所以反应速率加快。又因为反应前后体积不变,所以增大压强平衡不移动,但反应速率加快,答案选D。
本题难度:一般
|