1、选择题 反应4A(g)+5B(s)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L· s) B.v(A)= 0.030mol/(L ·s)
C.v(C)=0.040mol/(L· s) D.v(D)=0.090mol/(L· s)
2、填空题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值)
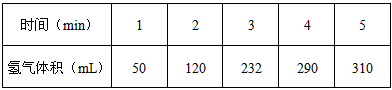
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大____________,原因是____________________________________。
(2)哪一段时段的反应速率最小____________,原因是________________________。
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)
________________________。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)____________。
3、选择题 关于反应CH3COOH+CH3CH2OH  ?CH3COOCH2CH3+H2O,下列说法错误的是
?CH3COOCH2CH3+H2O,下列说法错误的是
A.使用催化剂可以加快反应速率
B.升高温度可以加快反应速率
C.使用过量乙醇能使乙酸完全转化为乙酸乙酯
D.该反应属于取代反应
4、选择题 过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
[? ]
A.升高温度
B.加入适量的水
C.加入少量CuSO4
D.加入浓度较大的盐酸
5、选择题 一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是(?)
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大两倍再达到平衡后,测得A浓度为0.3 mol·L-1,则下列叙述正确的是(?)
A.平衡向正反应方向移动
B.x+y<z
C.C的体积分数降低
D.B的转化率提高