1、选择题 在恒温恒容的密闭容器中进行的气体反应:H2(g)+Br2(g) 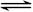 ?2HBr(g),能说明反应已达平衡状态的是 ( ? )
?2HBr(g),能说明反应已达平衡状态的是 ( ? )
A.容器内混合气体颜色不随时间改变而改变
B.H2、Br2的反应速率相等
C.容器内的压强不随时间改变而改变
D.混合气体的密度不随时间改变而改变
参考答案:A
本题解析:
正确答案:A
A.正确,容器体积不变,容器内混合气体颜色不随时间改变而改变,说明Br2浓度不变;? B.不正确,H2、Br2的方程式前计量数相同,H2、Br2的反应速率比是1:1
C.不正确,本反应是气体体积不变的反应,容器内的压强不随时间改变而改变? D.不正确,本反应全是气体,气体的总质量不随反应进行而改变,混合气体的密度不随时间改变而改变。
本题难度:一般
2、填空题 反应m A+n B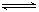 p C在某温度下达到平衡。
p C在某温度下达到平衡。
⑴若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是________________?。
⑵若C为气体,且m?+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
⑶如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
参考答案:⑴m+n > P ⑵逆?⑶气
本题解析:略
本题难度:一般
3、选择题 在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ?Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
?Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2,下列说法正确的是( )。
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.在80 ℃时,测得某时刻Ni(CO)4、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,Ni(CO)4的百分含量将增大
参考答案:BD
本题解析:根据题目得出,温度越高,平衡常数越小,平衡应该向左移动,正反应应该是放热反应,A错误;80 ℃时,Ni(CO)4、CO浓度均为0.5 mol·L-1,Q=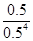 =8>K,故平衡应该逆向移动,因此v(正)<v(逆),B正确;恒温恒压下充入少量的Ar,体积变大,平衡逆向移动,C错误;向容器中再充入少量Ni(CO)4(g),平衡逆向移动,达新平衡时,Ni(CO)4(g)的百分含量将增大,D正确。
=8>K,故平衡应该逆向移动,因此v(正)<v(逆),B正确;恒温恒压下充入少量的Ar,体积变大,平衡逆向移动,C错误;向容器中再充入少量Ni(CO)4(g),平衡逆向移动,达新平衡时,Ni(CO)4(g)的百分含量将增大,D正确。
本题难度:一般
4、选择题 在常温下,X2(g)和H2反应生成HX的平衡常数如表中所示,仅依据K的变化,关于等物质的量浓度的H2与X2的反应,下列说法正确的是( )
化学方程式
| 平衡常数K
|
F2+H2 2HF 2HF
| 6.5×1095
|
Cl2+H2 2HCl 2HCl
| 2.6×1033
|
Br2+H2 2HBr 2HBr
| 1.9×1019
|
I2+H2 2HI 2HI
| 8.7×102
|
?
A.F2的转化率最大
B.X2与H2反应的剧烈程度逐渐减弱
C.X2与H2反应的反应速率依次减小
D.升高温度,平衡常数都增大
参考答案:A
本题解析:化学平衡常数越大,反应物的转化率越大,A项正确;仅由化学平衡常数不能得出反应速率的大小与反应的剧烈程度,B、C项错误;仅从平衡常数看不出反应是吸热还是放热,故无法知道平衡常数随温度变化的情况,D项错误
本题难度:一般
5、填空题 某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H2
2NH3达平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是:
①若x=0,y=0,则z=?;
②若x="0.75" mol,则y=?,z=?;
③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一
个含y、z)?。
若将上述条件改为恒温、恒压,其它均不变,则
a.若x=0,y=0,则z=?;
b.若x="0.75" mol,则y=?,z=?;
c.x、y、z取值必须满足的一般条件是?。
参考答案:①2mol②y=2.25mol,z=0.5mol
③z=2-2x,z=2-2/3y;a、z>0;b、y=2.25mol,z≥0;c、y=3x,z≥0.
本题解析:①恒温恒容条件下,改变初始物质的加入量,达到平衡时各物质的浓度不变,意味着新平衡与原平衡是等效平衡。对于反应前后气体的物质的量变化的可逆反应而言,两次加入的物质的物质的量完全相同即可达到等效平衡,所以开始充入1mol N2和3 mol H2,相当于充入2mol NH3,则x=0,y=0时,z=2mol;
②同理x=0.75mol,氢气的物质的量是氮气的3倍,则y=2.25mol,此时相当于充入1.5mol的NH3,所以只需再充入0.5mol NH3,即可达到与原平衡等效,即z=0.5mol
③根据①②的数据可得,x、y、z满足的条件是z=2-2x,z=2-2/3y;
若改为恒温恒压条件,则只需加入的物质的物质的量对应成比例即可达到等效平衡。a、若x=0,y=0,则z为任意不为0的数值;b、若x="0.75" mol,开始时氢气的物质的量是氮气的3倍,氨气无论是多少,转化为氮气、氢气时,二者的物质的量之比都是1:3,所以y=2.25mol,z≥0;c、由以上分析可知恒温恒压下,达到与原平衡等效时x、y、z取值必须满足的一般条件是y=3x,z≥0.
本题难度:一般