1、选择题 在一定温度下,下列叙述不是可逆反应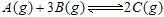 达到平衡的标志的是:
达到平衡的标志的是:
(1)C的生成速率与C的分解速率相等;
(2)单位时间内a mol A生成,同时生成3a mol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A、(2)(4)(5)
B、(2)(7)
C、(1)(3)(4)
D、(5)(6)(7)
参考答案:B
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项(1)、(3)正确;(2)中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不正确;根据方程式可知,反应前后体积是减小的,所以压强和气体的物质的量也是减小的,则选项(4)、(5)也可以说明;(6)中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以(7)不能说明,因此正确的答案选B。
本题难度:一般
2、选择题 在一密闭容器中,反应aA(g)==bB(g)达平衡后,保持温度不变,将容器体积扩大一倍,当达到新的平衡时,B的浓度是原来的60%,则(双选)……( )
A.平衡向正反应方向移动了
B.物质A的转化率减小了
C.物质B的质量分数增加了
D.a>b
参考答案:A、C
本题解析:平衡时,保持温度不变,将容器体积增加一倍,相当于压强减小原来的1/2,这一瞬间的浓度视为原来的50%。达新的平衡后,B的浓度是原来的60%,说明平衡向正反应方向移动了,A、C正确。A物质的转化率增大;减压,平衡向气体体积增大的方向移动,即a<b,故B、D不正确。
本题难度:一般
3、填空题 (6分)在80℃时,将0.40 mol N2O4气体充入2 L已经抽空的固定容积的密闭容器中发生反应N2O4(g) 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)
| 0
| 20
| 40
| 60
| 80
| 100
|
n(N2O4)/mol
| 0.40
| a
| 0.20
| c
| d
| e
|
n(NO2)/mol
| 0.00
| 0.24
| b
| 0.52
| 0.60
| 0.60
|
(1)计算a =?,此温度时该反应的平衡常数K=?;
(2)改变条件使反应重新达到平衡,能使c(NO2)/c(N2O4)值变小的措施有(填序号)?。
A.增大N2O4的起始浓度? B.升高温度
C.使用高效催化剂? D.向混合气体中通入稀有气体
参考答案:(1)a="0.28?" 1.8 mol / L(无单位或单位错误不给分)(2)A
本题解析:略
本题难度:一般
4、计算题 在2L定容密闭容器中加入反应物A、B,发生反应:A+3B=2C。反应经2min后,A的物质的量从开始时的2.4Amol下降到1.8?mol,已知起始B的物质的量为3.2mol。求:
(1)2?min末B的浓度;
(2)2min内C物质的平均速率。
参考答案:(1)0.7mol/L
(2)0.3mol/(L·min)
本题解析:
本题难度:一般
5、填空题 (1) (4分)在带有活塞的密闭容器中发生反应:Fe2O3+3H2===2Fe+3H2O,采取下列措施不能改变反应速率的是( )
A.增大Fe2O3的投入量
B.保持容器的体积不变,增加H2的输入量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器体积不变