1、实验题 (12分)今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
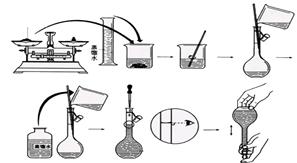
请根据题意回答:
(1)配制该溶液应选用?(填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应?。
(4)配制好的溶液?(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是??
A.容量瓶中原来有少量蒸馏水
B.定容时观察液面俯视
C.忘记洗涤
D.定容时观察液面仰视
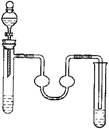
2、选择题 以下物质的制备实验装置正确的是
 ?
? ?
? ?
?
A.溴乙烷的制取
B.乙烯的制取
C.苯的硝化反应
D.乙酸丁酯(沸点126℃)的制备
3、实验题 (12分)为除去粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
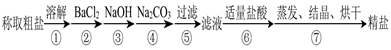
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
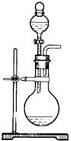
4、实验题 (12分)下图是实验室制取乙酸乙酯的实验装置。请回答:
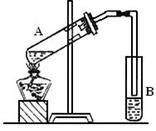
(1)在M试管中加碎瓷片的作用是?。
试管N中盛放的溶液是_________________ 。
该溶液的作用为中和乙酸,吸收挥发出的乙醇,?;
导管在其 液面上而不插入液面下的原因是?。
(2)在大试管中配制一定比例的乙醇、浓硫酸和乙酸
混合液时,加入试剂的顺序是?。
(3)浓硫酸的作用是?。
(4)反应结束后,试管N内的液体分成两层,反应生成的乙酸乙酯在?层(填写“上”或“下”)。若分离N中的液体混合物需要用到的玻璃仪器是烧杯、?。
(5)M试管中发生反应的化学方程式?。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯
化反应已达到化学平衡状态的是 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
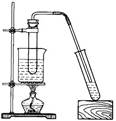
5、实验题 由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙膏皮,
各自设计一种装置来制取一试管氢气。他们设计装置如图所示:

(1)上述两装置相比,____________(填“甲”或“乙”)装置设计更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试管,应采取的措施
是__________________________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?___________(填写一种物质即可)。