1、实验题 (12分)今欲用NaOH固体配制100mL 0.5mol/L的NaOH溶液。配制过程如下图所示:
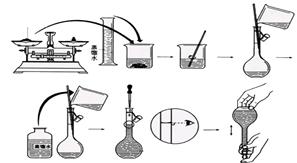
请根据题意回答:
(1)配制该溶液应选用?(填仪器)。
(2)用______(填滤纸或小烧杯)在托盘天平上称取_____ NaOH固体。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应?。
(4)配制好的溶液?(填“能”或“不能”)长期存放在容量瓶中。
(5)以下因素会造成实验结果偏低的是??
A.容量瓶中原来有少量蒸馏水
B.定容时观察液面俯视
C.忘记洗涤
D.定容时观察液面仰视
参考答案:(1)100 mL容量瓶(只答?容量瓶给一分)?
(2)小烧杯、2g(只填数据0分)
(3)重做?(4)不能?(5)CD(少一个得1分,错一个得0分)
本题解析:考查一定物质的量浓度溶液的配制。
(1)准确配制100mL 0.5mol/L的NaOH溶液,应该选择100ml容量瓶。
(2)100mL 0.5mol/L的NaOH溶液中含有氢氧化钠是0.1L×0.5mol/L=0.05mol,质量是m=0.05mol×40g/mol=2.0g。又因为氢氧化钠具有吸水性和腐蚀性,因此称量时应该放在小烧杯中。
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,则只能是重新配制。
(4)容量瓶不能长时间盛放溶液,因此配制完之后,必须及时转移到相应的试剂瓶中。
(5)根据 可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。
可知,容量瓶中原来有少量蒸馏水,对结果是无影响的。定容时观察液面俯视,则容量瓶中溶液的体积偏少,浓度偏大,则选项D就偏低。忘记洗涤,则溶质的物质的量偏少,浓度偏低,答案选CD。
本题难度:一般
2、选择题 以下物质的制备实验装置正确的是
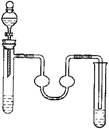 ?
?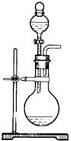 ?
? ?
?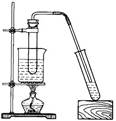
A.溴乙烷的制取
B.乙烯的制取
C.苯的硝化反应
D.乙酸丁酯(沸点126℃)的制备
参考答案:C
本题解析:
正确答案:C
A、不正确,要加热;B、不正确,少温度计;C、正确;D、不正确,不用水浴加热
本题难度:简单
3、实验题 (12分)为除去粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
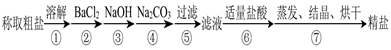
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
参考答案:(1)搅拌,加速固体溶解 ;引流 。
(2)取上层清液,继续加BaCl2,无沉淀产生?。
(3)Ca2++CO =CaCO3↓、Ba2++CO
=CaCO3↓、Ba2++CO =BaCO3↓ 。
=BaCO3↓ 。
(4)若过滤前加盐酸,前面所生成的沉淀会被盐酸溶液重新变为离子进入溶液。
本题解析:(1)在第①步,玻璃棒作用是搅拌,加速固体溶解;第⑤步在过滤操作玻璃棒的作用是引流。(2)取上层清液,继续加BaCl2,无沉淀产生,说明BaCl2已过量。另外判断BaCl2已过量也可以看Ba2+是不是过量,即是取上层清液,加入少量稀硫酸,有沉淀产生。(3)在第②步中除去SO42-,在第③步中除去Mg2+,所以第④步中除去Ca2+及过量的Ba2+,所以Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓. (4)若过滤前加盐酸, CaCO3和BaCO3会与盐酸反应,又形成Ca2+和Ba2+进入溶液。
点评:考查了化学实验的一些基本操作,以及除杂加入试剂的顺序,和离子方程式的书写,都是高考化工流程题的常见考点。
本题难度:一般
4、实验题 (12分)下图是实验室制取乙酸乙酯的实验装置。请回答:
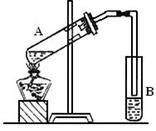
(1)在M试管中加碎瓷片的作用是?。
试管N中盛放的溶液是_________________ 。
该溶液的作用为中和乙酸,吸收挥发出的乙醇,?;
导管在其 液面上而不插入液面下的原因是?。
(2)在大试管中配制一定比例的乙醇、浓硫酸和乙酸
混合液时,加入试剂的顺序是?。
(3)浓硫酸的作用是?。
(4)反应结束后,试管N内的液体分成两层,反应生成的乙酸乙酯在?层(填写“上”或“下”)。若分离N中的液体混合物需要用到的玻璃仪器是烧杯、?。
(5)M试管中发生反应的化学方程式?。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯
化反应已达到化学平衡状态的是 (填序号)。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
参考答案:(1)防止暴沸。饱和碳酸钠溶液。降低乙酸乙酯的溶解度,便于分层。防止倒吸。
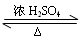
(2)先加入乙醇,在缓慢加入浓硫酸,冷却后在加入乙酸。
(3)催化剂和吸水剂。
(4)上,分液漏斗。
(5)CH3COOH + C2H5OH? CH3COOC2H5 + H2O
(6)②
本题解析:考查乙酸乙酯的制备。

(1)酯化反应需要加热,为了防止液体沸腾时剧烈跳动,需要加热碎瓷片以防止暴沸。乙酸和乙醇都易挥发,所以生成的乙酸乙酯中含有乙酸和乙醇。加入饱和碳酸钠一方面可以吸收乙醇,中和乙酸,另一方面可以降低乙酸乙酯的溶解度,有利于分层析出。乙酸和乙醇和水互溶,所以不能直接插入溶液中,以防止倒吸。
(2)浓硫酸溶于水放出大量的热,且浓硫酸的密度大于水的,为了防止乙酸和乙醇的挥发,应该先加入乙醇,在缓慢加入浓硫酸,冷却后在加入乙酸。
(3)因为是可逆反应,所以浓硫酸除了作催化剂以外,还起吸水剂的作用,使反应有利于向生成乙酸乙酯的方向移动。
(4)乙酸乙酯的密度比水的小,且难溶于水,所以在上层,通过分液漏斗即可实现分离。
(5)反应方程式为CH3COOH + C2H5OH? CH3COOC2H5 + H2O。
(6)①③中反应速率的方向是相同的,在任何情况下恒成立。②反应速率的方向是相反的,且满足速率之比是相应的化学计量数之比,正确。
本题难度:一般
5、实验题 由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙膏皮,
各自设计一种装置来制取一试管氢气。他们设计装置如图所示:

(1)上述两装置相比,____________(填“甲”或“乙”)装置设计更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试管,应采取的措施
是__________________________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?___________(填写一种物质即可)。
参考答案:(1)甲 (2)先使反应的试管口伸入收集试管的底部,然后慢慢往下移动 (3)废铁皮、铁钉、食醋等。
本题解析:用甲同学设计的装置实验时,产生的氢气由于密度小,而集中在大试管顶部,这时如果把大试管缓缓上移或小试管慢慢往下移动,就可把空气从试管中逐渐排出,从而收集到较为纯净的一试管氢气。而如果用乙同学设计的装置实验,产生的氢气大都从两试管的缝隙排出,同时由于小试管中的空气不易排出,而很难收集到纯净的氢气。
本题难度:简单