1、选择题 同温同压下,容器A中HCl与容器B中NH3所含原子数相等,容器A与容器B的体积之比是
A.1:4
B.4:1
C.1:2
D.2:1
参考答案:D
本题解析:分析:同温同压下,气体的Vm相等,容器A中HCl与容器B中NH3所含原子数相等,则分子数之比为2;1,结合n=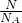 =
=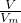 计算.
计算.
解答:同温同压下,气体的Vm相等,容器A中HCl与容器B中NH3所含原子数相等,则分子数之比为2;1,由n=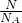 =
=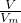 可知,气体的体积之比等于气体的物质的量之比,为2;1,
可知,气体的体积之比等于气体的物质的量之比,为2;1,
故选D.
点评:本题考查阿伏伽德罗定律及其推论,题目难度不大,注意同温同压下,气体的Vm相等,特别是物质的分子构成特点,为解答该题的关键.
本题难度:一般
2、选择题 下列各组比值中,等于1:3的是
①硝酸铁溶液中,c(Fe3+):c(NO3-)②pH=1的盐酸跟pH=3的盐酸的物质的量浓度之比 ③0.1mol/L醋酸跟0.3mol/L醋酸溶液中氢离子浓度之比?④0.1mol/L的醋酸钠跟0.3mol/L的氯化钠溶液中的Na+离子浓度之比.
A.①②
B.①②③
C.③④
D.只有④
参考答案:D
本题解析:分析:①硝酸铁是强酸弱碱盐,所以铁离子发生水解.
②先把溶液的PH值换算成氢离子浓度,然后进行比较大小.
③要计算弱电解质溶液中氢离子浓度,不仅要知道?醋酸的浓度还要知道电离度.
④先判断盐是否水解再比较离子浓度.
解答:①硝酸铁溶液中,硝酸铁是强酸弱碱盐,所以铁离子水解而硝酸根离子不水解,导致溶液中c(Fe3+):c(NO3-)<1:4,故错误.
②pH=1的盐酸溶液中物质的量浓度为0.1mol/L,pH=3的盐酸的物质的量浓度为0.001mol/L,所以pH=1的盐酸跟pH=3的盐酸的物质的量浓度之比为100:1,故错误.
③0.1mol/L醋酸跟0.3mol/L醋酸溶液中氢离子浓度之比,因为醋酸是弱电解质,要想计算醋酸溶液中氢离子的浓度,不仅要知道溶液的浓度还要知道弱电解质的电离度;因为该题只知溶液的浓度,弱电解质的电离度未知,所以无法计算,故错误.
④醋酸钠和氯化钠溶液中钠离子是强离子不水解,溶液中钠离子的浓度就等于原溶液的浓度,所以0.1mol/L的醋酸钠跟0.3mol/L的氯化钠溶液中的Na+离子浓度之比为1:3.
故选D.
点评:本题以物质的量浓度比较为载体考查了盐类水解、弱电解质的电离等知识点,难度不大,注意氢离子浓度与PH值的换算.
本题难度:一般
3、选择题 在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)=0.10mol?L-1,c(Mg2+)=0.25mol?L-1,c(Cl-)=0.20mol?L-1,则c(SO42-)为
A.0.15mol?L-1
B.0.10mol?L-1
C.0.25mol?L-1
D.0.20mol?L-1
参考答案:D
本题解析:分析:令硫酸根的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等,列式计算c值.据此判断.
解答:令硫酸根的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等,则:
0.10mol?L-1×1+0.25mol?L-1×2=0.20mol?L-1×1+2c
解得:c=0.2mol/L.
故选:D.
点评:考查溶液物质的量浓度的计算,难度不大,利用常规解法,比较麻烦,本题根据溶液不显电性阳离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有关离子浓度计算经常运用.
本题难度:一般
4、选择题 在含有NaCl、KCl、Na2SO4、K2SO4四种物质的混合溶液中,已知Na+、Cl-和K+的物质的量浓度分别为0.8 mol/L、0.7 mol/L和0.4 mol/L,则SO42-的物质的量浓度是
A.0.50 mol/L
B.0.40 mol/L
C.0.30 mol/L
D.0.25 mol/L
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列实验能达到目的是( )
A.用过量氨水除去AlCl3溶液中的少量FeCl3
B.用淀粉溶液鉴别含碘食盐和不含碘食盐
C.若CO2中含少量氯化氢,可通入盛有水的洗气装置将氯化氢除去
D.O2中所含的Cl2,通过盛有NaOH溶液的洗气装置将Cl2除去
参考答案:D
本题解析:
本题难度:简单