1、简答题 短周期元素X、Y、Z组成的化合物Y2X和ZX2,Y2X溶于水形成的水溶液能与ZX2?反应生成一种化合物Y2ZX3,已知三种元素原子的电子总数为25,且Z与Y的原子序数之和比X的原子序数的2倍还多1,Z原子的最外层电子数是次外层电子数的2倍.试回答:
①X、Y、Z元素的名称:X______?Y______?Z______
②写出X元素、Y元素能够形成的两种化合物的化学式______、______
③化合物Y2X对应的水化物的电子式为______用电子式表示Y2X的形成过程:______
?④X、Y、Z三种元素的电负性由大到小顺序是:______
?⑤Y2X溶于水形成的水溶液能与ZX2?反应生成化合物Y2ZX3.写出该过程的离子方程式:______.
参考答案:由Z原子的最外层电子数是次外层电子数的2倍,则Z为两个电子层时,推出Z为碳元素,
再由三种元素原子的电子总数为25,且Z与Y的原子序数之和比X的原子序数的2倍还多1,则设X原子的质子数为x,Y原子的质子数为y,根据题意,可得出以下关系:?
本题解析:
本题难度:一般
2、选择题 A、B、C三种短周期元素在元素周期表中的位置如图所示,已知A、C元素可分别与B元素形成化合物X和Y,A与B的质子数之和等于C的质子数.现有以下说法,其中判断正确的组合是( )
①B与C均存在同素异形体
②X的种类比Y的多
③沸点:A的最简单氢化物低于C的最简单氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐.
A.①②③④
B.②③
C.①②④
D.①④
参考答案:A、B、C三种短周期元素,设A的质子数为x,则由图可知,C的质子数为x+8,B的质子数为x+1,A与B的质子数之和等于C的质子数,则x+x+1=x+8,解得x=7,即A为N,B为O,C为P,
①B的同素异形体有氧气与臭氧,C的同素异形体有白磷和红磷,故①正确;
②A、C元素可分别与B元素形成化合物X和Y,N的氧化物有6种,P的氧化物主要有2种,则X的种类比Y的多,故②正确;
③氨气中含有氢键,磷化氢中不存在氢键,则A的最简单氢化物的沸点高于C的最简单氢化物,故③错误;
④C的最高价氧化物对应水化物为磷酸,属于三元酸,能与A的氢化物氨气形成三种盐,分别为正盐和磷酸一氢盐、磷酸二氢盐,故④正确;
故选C.
本题解析:
本题难度:一般
3、填空题 (15分)X、Y、Z、Q、W为按原子序数由小到大排列的五种短周期元素,已知:
①X元素与Q处于同一主族,其原子价电子排布式都为ns2np2,且X原子半径小于Q的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ·mol-1):
I1
| I2
| I3
| I4
| …
|
496
| 4562
| 6912
| 9540
| …
|
?
请回答:
(1)XY2分子空间构型为?,X原子的轨道杂化方式为?;QX的晶体结构与金刚石的相似,其中X原子的杂化方式为?,微粒间存在的作用力是?。
(2)晶体ZW的熔点比晶体XW4明显高的原因是?。
(3)氧化物MO的电子总数与QX的相等,则M为______________(填元素符号)。MO是优良的耐高温材料,其晶体结构与ZW晶体相似。MO的熔点比CaO的高,其原因是_________________________。

(4)ZW晶体的结构示意图如右图。已知:ρ(ZW)=2.2 g·cm-3,NA=6.02×1023mol-1,则ZW晶体中两个最近的Z离子中心间的距离为?。
参考答案:⑴?直线型分子;? sp杂化; sp3杂化;共价键 ; ⑵NaCl为离子晶体而CCl4为分子晶体;
⑶Mg? Mg2+半径比Ca2+小,MgO晶格能大?⑷? 4.0×10-8 cm
本题解析:根据题意可推知各种元素分别为:X是C;Y的O;Z是Na;Q是Si;W是Cl。(1)CO2分子空间构型为直线型;其中X原子的轨道杂化方式为sp杂化;SiC的晶体结构与金刚石的相似,是原子晶体,其中C原子的杂化方式为sp3杂化;C原子与Si原子之间的作用力是共价键。(2)NaCl晶体是离子晶体,离子间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此该化合物的熔点高;而CCl4是由分子通过分子间作用力结合,分子间作用力是一种比较弱的作用,破坏比较容易,因此该晶体的熔沸点比较低,CCl4在室温下为液态。(3)SiC的电子数是20,而氧化物MO的电子总数与SiC的相等,则M的电子数是12,该元素是Mg;MgO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MgO的熔点比CaO的高,是因为Mg2+半径比Ca2+小,MgO晶格能大,断裂其离子键比CaO难,所以熔点较高。(4)在一个晶胞中含有的Na+:8×1/8+6×1/2=4;含有的Cl-:12×1/4+1=4.即一个晶胞中含有4个NaCl.所以晶胞的边长为L,则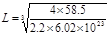 在晶胞中两个最近的Na+的距离是
在晶胞中两个最近的Na+的距离是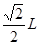 整理解得
整理解得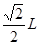 =4.0×10-8 cm。
=4.0×10-8 cm。
本题难度:一般
4、选择题 下列叙述中正确的是
[? ]
A.干冰气化时碳氧键发生断裂
B.CaO和SiO2晶体中都不存在单个小分子
C.Na2O与Na2O2所含化学键类型完全相同
D.Br2蒸汽被木炭吸附时共价键被破坏
参考答案:B
本题解析:
本题难度:简单
5、选择题 某主族元素R的原子其电子式可用下式表示: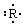 。该元素组成的以下物质,其分子式肯定错误的是
。该元素组成的以下物质,其分子式肯定错误的是
[? ]
A.最高价氧化物分子式为R2O5
B.含氧酸分子式为 HRO3
C.含氧酸分子式为H3RO4
D.气态氢化物分子式为RH5
参考答案:D
本题解析:
本题难度:简单