1、选择题 下列有关化学用语的说法中不正确的是
[? ]
A.-OH与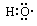 都表示羟基
都表示羟基
B.CH4Si的结构式: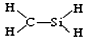
C.CH4分子的球棍模型:
D.次氯酸分子的电子式: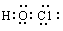
参考答案:B
本题解析:
本题难度:简单
2、填空题 太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为?。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为?(用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为???;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为???。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。
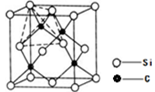
①在SiC中,每个C原子周围最近的C原子数目为???;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是?(填序号)。
参考答案:(12分)
(1)3d10 (2分)?(2)Br>As>Se (2分)? (3)①SP3(2分)
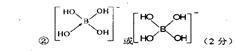
(4)①12(2分)②b<c<a(2分)
本题解析:
(1)亚铜离子是由铜原子失去了一个电子得到的,所以有28个电子,所以为3d10;
(2)由于AS的外围电子排布式为4S24P3每个轨道电子处于半充满状态,能量比较低,比较稳定,失去电子较困难。
(3)①根据价层电子互斥理论,[B(OH)4]-中B中价电子数为(3+4+1)/2=4,所以应该是SP3杂化;
②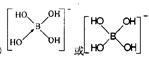
(4)①在SiC中,每个SI和周围的四个原子以共价键结合,其结构和金刚石相同。观察其结构图可知应该为12;②b.干冰c.冰是分子晶体,但冰中存在氢键,所以晶体的熔点从小到大的顺序是b<c<a。
本题难度:困难
3、简答题 四种短周期元素的性质或结构信息如表所示,请根据信息回答下列问题:
| 元素 | A | B | C | D
性质或结构信息
室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧发出明亮的蓝紫色火焰
单质在常温、常压下是气体,能溶于水;原子的M层比L层少1个电子
单质为质软、银白色固体,导电性强;单质在空气中燃烧发出黄色火焰
原子的最外电子层上电子数比内层电子总数少6;单质为空间网状晶体,具有很高的熔沸点
|
(1)B在元素周期表中的位置是第______周期______族,写出A原子的原子结构示意图:______.
(2)写出C单质与水反应的化学方程式:______.A与C形成的化合物溶于水后,溶液的pH______7(填“大于”、“等于”或“小于”).
(3)D的最高价氧化物晶体的硬度______(填“大”或“小”),其理由是______.
(4)A、B两元素非金属性较强的是(写元素符号)______;写出能证明这一结论的实验事实:______.
参考答案:A、B、C、D四种短周期元素:室温下A的单质呈粉末状固体,加热易熔化,在氧气中燃烧发出明亮的蓝紫色火焰,则A为硫元素;B元素原子的M层比L层少1个电子,则M层有7个电子,故B为Cl元素;C的单质为质软、银白色固体,导电性强,在空气中燃烧发出黄色火焰,则C为Na元素;D元素原子的最外电子层上电子数比内层电子总数少6,则D原子有3个电子层,最外层电子数为4,为Si元素,
(1)B为Cl元素,在元素周期表中的位置是第三周期ⅦA族,S原子的原子结构示意图为:
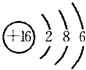
,
故答案为:三;ⅦA;

;
(2)Na与水反应的化学方程式:2Na+2H2O=2NaOH+H2↑,Na2S溶液中硫离子水解,溶液呈碱性,溶液pH>7,
故答案为:2Na+2H2O=2NaOH+H2↑;
(3)二氧化硅属于原子晶体,硬度大,故答案为:大;二氧化硅属于原子晶体;
(4)同周期自左而右非金属性增强,故Cl元素非金属性较强,高氯酸的酸性比硫酸酸性强可以说明氯元素的非金属性强,
故答案为:Cl;高氯酸的酸性比硫酸酸性强.
本题解析:
本题难度:一般
4、填空题 12分)
氟、氯、溴3种元素同属于周期表中第VIIA族。
(1)3种元素中电负性最小的基态原子的价电子排布式是?。
(2)氢氟酸是弱酸的原因是?。
(3)氯元素可广泛存在于无机物和有机物中。二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是____,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是??分子。(“极性”或“非极性”)
(4)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电。在冰晶石(Na3AlF6)晶体中存在?(填选项)。
A.离子键
B.极性键
C.配位键
D.范德华力