1、填空题 Ⅰ.为了除去KCl溶液中少量的Mg2+、SO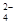 ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
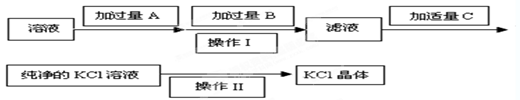
(1)上述试剂中, B是?,C是?。
(2)操作Ⅱ的名称是?。
(3)加过量A时发生有关反应的离子方程式为 ??、??。
Ⅱ.一份无色稀溶液中可能含有Na+、Fe3+、H+、Mg2+、CO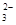 ?、OH-、HCO
?、OH-、HCO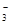 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①用石蕊试纸测溶液的酸碱性,试纸显蓝色;
②取2毫升溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是?,一定不存在的离子是?。
(2)经过上述操作后,还不能肯定是否存在的离子是?。请你设计一个简单的实验方案来判断是否存在这种离子。?
参考答案:Ⅰ(1)K2CO3(1分); HCl(1分);? (2)蒸发结晶(1分);
(3)Mg2++2OHˉ=Mg(OH)2↓(2分);Ba2++SO42ˉ=BaSO4↓(2分);
Ⅱ(1)Na+,CO32ˉ,OHˉ(2分);Fe3+,H+,Mg2+,HCO3ˉ(2分);(全对得2分,漏写得1分,有错不得分)
(2)Clˉ(1分); 取少量原溶液,加入足量稀硝酸酸化,再滴加少量AgNO3,若有白色沉淀产生,则有Clˉ,否则没有。(2分)
本题解析:
Ⅰ.(1)氢氧化钡可以将MgCl2、MgSO4中的氢氧根和硫酸根除去,除杂时,每一步所加的试剂均是过量的,过量的氢氧化钡需用碳酸钾除去,而多余的碳酸钾需用盐酸来除去,故试剂A、B、C依次是Ba(OH)2、K2CO3、HCl,
(2)液体和固体分离的方法是过滤,所用玻璃仪器有漏斗、玻璃棒、烧杯,物质的溶液获得晶体的方法是蒸发结晶,
(3)氢氧化钡可以将MgCl2、MgSO4中的氢氧根和硫酸根除去,方程式分别为:MgCl2+Ba(OH)2═BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2═BaSO4↓+Mg(OH)2↓,
Ⅱ(1)用石蕊试纸测溶液的酸碱性,试纸显蓝色,说明溶液呈碱性。与OH-离子反应的离子不能共存,Fe3+、H+、Mg2+、HCO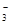 排除。加足量稀硝酸酸化,有气体产生,说明含有CO
排除。加足量稀硝酸酸化,有气体产生,说明含有CO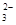 。所以原溶液中一定存在的离子是Na+(溶液中至少含有一种阳离子),CO32ˉ,OHˉ;一定不存在的离子是Fe3+,H+,Mg2+,HCO3ˉ;还不能肯定是否存在的离子是Clˉ;取少量原溶液,加入足量稀硝酸酸化,再滴加少量AgNO3,若有白色沉淀产生,则有Clˉ,否则没有。
。所以原溶液中一定存在的离子是Na+(溶液中至少含有一种阳离子),CO32ˉ,OHˉ;一定不存在的离子是Fe3+,H+,Mg2+,HCO3ˉ;还不能肯定是否存在的离子是Clˉ;取少量原溶液,加入足量稀硝酸酸化,再滴加少量AgNO3,若有白色沉淀产生,则有Clˉ,否则没有。
本题难度:一般
2、选择题 下列反应的离子方程式书写正确的是
A.Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓
B.NaOH溶液与稀硝酸的反应:NaOH+H+=Na++H2O
C.NaHCO3溶液与盐酸的反应:CO32-+2H+=H2O+CO2↑
D.KCl溶液与AgNO3溶液的反应:Cl-+Ag+=AgCl↓
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列物质的溶液中,加入Ba(OH)2溶液,原溶液的阴、阳离子数目都减少的是
[? ]
A.CuSO4
B.Ca(NO3)2
C.Na2CO3
D.FeCl3
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列离子化合物,熔点最高的是
A.氯化钠
B.氯化钾
C.氯化锂
D.氯化铯
参考答案:C
本题解析:离子化合物熔、沸点的高低取决于离子键的强弱,离子键越强,破坏它就越难,即所需提供的热能越多,其熔、沸点就越高.离子键的强弱,取决于离子半径的大小和离子所带电荷数的多少,离子半径之和越短,离子所带电荷越多,其熔、沸点越高,反之则越低.
题中,4种离子化合物,氯离子半径是相同的,由于r(Li+)<r(Na+)<r(K+)<r(Cs+),故离子键的强弱依次是LiCl>NaCl>KCl>CsCl,故氯化锂熔点最高.
本题难度:简单
5、选择题 在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3-、NO3-
B.NH4+、SO42-、Al3+、NO3-
C.Na+、Ca2+、NO3-、CO32-
D.K+、MnO4-、NH4+、NO3-
参考答案:B
本题解析:试题分析:A项:HCO3-能与酸中的H+反应,不能共存,故错;C项:CO32-能与酸中的H+还有Ca2+反应,不能共存,故错;D项:MnO4-有颜色,不能共存,故错。故选B。
考点:离子共存
点评:本题考查离子的共存问题,熟悉离子的性质及发生的反应是解答本题的关键,难度不大。(1)离子间相互结合形成沉淀、气体、弱电解质、络离子时不能大量共存;离子间发生双水解反应、氧化还原反应时不能大量共存。(2)注意题目的限制条件。
本题难度:简单