1、简答题 化学学习小组为测定“阳光”牌小包装中Fe粉和活性炭质量之比进行了以下探究:
查阅资料:“阳光”牌小包装“脱氧剂”成份为Fe粉、活性炭及少量NaCl、水.
实验步骤:
步骤一:取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末.
步骤二:将步骤一中的固体溶于水,过滤,将滤渣洗涤、干燥,以除去“脱氧剂”中NaCl和水;
步骤三:取步骤二中的滤渣,将其分为两等份,每一份质量为16.0g.将其中一份在氧气流中充分灼烧,生成的气体全部通入足量得澄清石灰水,得到干燥、纯净的沉淀20.0?g.
步骤四:将步骤三中的另一份滤渣放入烧杯中,加入一定体积足量的稀H2SO4,微热至反应完全.
步骤五:向步骤四的混合物中加入过量的氢氧化钠溶液,过滤后得固体,经洗涤后转移到坩埚中充分加热,冷却、称量,得到固体质量仍为16g.
请回答下列问题:
(1)由步骤一可知,上述“脱氧剂”中的红棕色物质为______(填化学式);
(2)由步骤三可知,16.0?g滤渣中活性炭的质量为______g;
(3)综上实验所知:该“脱氧剂”中未被氧化的Fe粉和活性炭质量之比为______;
(4)该“脱氧剂”中,铁已被氧化的百分率为______.
参考答案:(1)在金属铁的氧化物中,只有氧化铁是红棕色的固体,所以“脱氧剂”中的红棕色物质为Fe2O3,故答案为:Fe2O3;
(2)由步骤三结合碳元素守恒,得到干燥、纯净的沉淀20.0g即为碳酸钙的总质量,设碳单质的质量为x,则
C~CO2~CaCO3,
12? 100
x? 20g
12x=10020g,
解得x=2.4g,所以16.0g滤渣中活性炭的质量为2.4g,故答案为:2.4g;
(3)根据实验,向金属铁以及氧化铁的混合物中加入一定体积足量的稀H2SO4,微热至反应完全.再加入过量的氢氧化钠溶液,过滤后会得固体氢氧化铁,经洗涤后转移到坩埚中充分加热,冷却、称量,得到固体氧化铁质量为16g即为0.1mol,则根据铁元素守恒,设金属铁的物质的量为m,氧化铁的物质的量为n,
则
本题解析:
本题难度:一般
2、选择题 下列反应属于氧化还原反应的是( )
A.CuO+2HCl═CuCl2+H2O
B.CaO+H2O═Ca(OH)2
C.CaCO3
CaO+CO2↑
D.2KClO32KCl+3O2↑
参考答案:A.该反应中没有元素的化合价变化,为非氧化还原反应,故A不选;
B.该反应中没有元素的化合价变化,为非氧化还原反应,故B不选‘
C.该反应中没有元素的化合价变化,为非氧化还原反应,故C不选;
D.反应中,Cl元素的化合价降低,O元素的化合价升高,属于氧化还原反应,故D选;
故选D.
本题解析:
本题难度:一般
3、简答题 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是______.
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应.
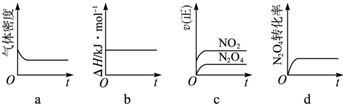
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol?N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是______.若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=______?mol/(L?s)-1.
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a?mol?NH4NO3溶于水,溶液显酸性,原因是______(用离子方程式表示).向该溶液滴加b?L?氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为______mol?L-1.(NH3?H2O的电离平衡常数取Kb=2×10-5?mol?L-1)
参考答案:(1)反应(I)中,N2O4(l)中N元素得电子化合价降低,所以N2O4(l)是氧化剂,故答案为:氧化剂;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中;
a、密度等于质量除以体积,平衡体系质量不变,反应体积增大,密度在反应过程中不变,说明反应达到平衡,故a符合;
b、反应的焓变和反应物与生成物能量总和之差计算,与平衡无关,故b不符合;
c、图象制表示正反应速率变化,不能证明正逆反应速率相同,故c不符合;
d、N2O4(l)转化率不变,证明反应达到平衡,故d符合;
示意图正确且能说明反应达到平衡状态的是ad;K=c2(NO2)c(N2O4),化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO2)=△c△t=0.6mol1L3s=0.2mol/L.s,则v(N2O4)=12v(NO2)=0.1mol/L.s;
故答案为:ad;不变;0.1;
(4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O?NH3?H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,溶液中氢氧根离子浓度=10-7mol/L;NH3?H2O的电离平衡常数取Kb=2×10-5 mol?L-1,设混合后溶液体积为1L,根据一水合氨电离平衡得到:NH3?H2O?NH4++OH-,平衡常数K=c(NH4+)c(OH-)c(NH3?H2O)=bmol/L×10-7mol/Lb×c(NH3?H2O)mol/L=2×10-5 mol?L-1,计算得到c(NH3?H2O)=a200bmol/L,
故答案为:NH4++H2O?NH3?H2O+H+;逆向;a200b.
本题解析:
本题难度:一般
4、填空题 实验室常用浓HCl与MnO2的反应制取少量的氯气,其化学方程式为MnO2+4HCl=MnCl2+Cl2↑+2H2O取一定量的浓盐酸与二氧化锰发生反应,产生的氯气在标况下的体积为11.2L.则反应中的氧化剂为______(填化学式),质量为______;还原剂为______(填化学式),物质的量为______;转移电子的数目为______.
参考答案:产生的氯气在标况下的体积为11.2L,其物质的量为11.2L22.4L/mol=0.5mol,
MnO2+4HCl=MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,则MnO2为氧化剂,由MnO2~Cl2↑可知,其质量为0.5mol×87g/mol=43.5g,
Cl元素的化合价升高,则HCl为还原剂,由2HCl~Cl2↑可知,还原剂的物质的量为0.5mol×2=1mol,
由Cl2↑~2e-可知,转移电子数目0.5mol×2×NA=NA个,
故答案为:MnO2;43.5g;HCl;1mol;NA.
本题解析:
本题难度:一般
5、选择题 下列反应中不属于氧化还原反应的是( )
A.Cl2+2NaOH═NaCl+NaClO+H2O
B.NH3+HCl═NH4Cl
C.Br2+2KI═I2+2KBr
D.2H2O2═2H2O+O2↑
参考答案:A、Cl2+2NaOH═NaCl+NaClO+H2O反应中,Cl元素的化合价发生变化,属于氧化还原反应,故A不选;
B、NH3+HCl═NH4Cl反应中,化合物所含元素的化合价没有发生变化,不属于氧化还原反应,故B选;
C、Br2+2KI═I2+2KBr反应中,Cl、Br元素的化合价发生变化,属于氧化还原反应,故C不选;
D、2H2O2═2H2O+O2↑反应中,O元素的化合价发生变化,属于氧化还原反应,故D不选.
故选B.
本题解析:
本题难度:简单