1、选择题 标准状况下,在三个干燥烧瓶一瓶为干燥纯净氨气,一瓶含一半空气的氯化氢和一瓶为二氧化氮和氧气的混合气(体积比:V(NO2):V(O2)=4:1),然后分别做喷泉实验,则三瓶中所得溶液的物质的量浓度之比为(? )
A.2:1:2
B.5:5:4
C.1:1:1
D.无法确定
参考答案:B
本题解析:假设烧瓶的容积为1L,则氨气的物质的量是 摩尔,溶液的体积是烧瓶的容积,则物质的量浓度是
摩尔,溶液的体积是烧瓶的容积,则物质的量浓度是 mol/L,含一半空气的氯化氢的物质的量是
mol/L,含一半空气的氯化氢的物质的量是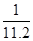 摩尔,溶液的体积是氯化氢的体积,即烧瓶容积的一半,则物质的量浓度是
摩尔,溶液的体积是氯化氢的体积,即烧瓶容积的一半,则物质的量浓度是 mol/L,二氧化氮和氧气的混合气(体积比:V(NO2):V(O2)=4:1),
mol/L,二氧化氮和氧气的混合气(体积比:V(NO2):V(O2)=4:1),
4NO2+O2+2H2O=4HNO3,硝酸的物质的量是NO2的物质的量,是 摩尔,溶液的体积是烧瓶容积,则物质的量浓度是
摩尔,溶液的体积是烧瓶容积,则物质的量浓度是 mol/L,所以比值是5:5:4,B正确。
mol/L,所以比值是5:5:4,B正确。
本题难度:一般
2、选择题 下列叙述中,正确的是

A.1 mol 乙醇分子中含有的共价键数为7×6.02×1023

B.1 mol甲基(-CH3)中含有的电子数为10×6.02×1023

C.14 g乙烯和丙烯的混合物中含有的碳原子数为1×6.02×1023
D.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023
参考答案:C
本题解析:略
本题难度:一般
3、选择题 (1)5.4克H2O含有?molH。
(2)3.01×1024个OH—与?molNH3的质量相同。
(3)15.6 g Na2X中含Na+ 0.4mol,则X的相对原子质量是?。
(4)3.6g重水2H2O含电子物质的量为?。
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)?。
参考答案:(1)0.6mol? (2)5mol (3) 32 (4)1.8mol (5)AB3或B3A
本题解析:(1)5.4/18*2="0.6" (2)3.01×1024/6.02×1023=5mol,因二者摩尔质量相同,答案为5mol。(3)15.6/0.2-46=32? (4) 3.6/20*10=1.8mol? (5) 同温同压下,气体的体积之比等于物质的量之比。利用原子守恒即可推出。
本题难度:简单
4、计算题 (14分)将5.6g铁粉放入200ml的某浓度的盐酸中,恰好完全反应,求:
(1)铁粉的物质的量是?
(2)写出其反应的离子方程式
(3)盐酸的浓度(计算过程):
(4)生成H2在标准状况下的体积为______
(5)如果把盐酸改为稀硫酸,则稀硫酸的浓度为________。
参考答案:(1)0.1mol?(2分无单位0分)
(2) Fe + 2H+ = H2# + Fe2+(3分无气体符号扣1分)
(3) Fe? +? 2HCl =? H2# +? FeCl2
1? 2? 1
0.1mol? 0.2mol? 0.1mol?(2分)
C(HCl) = 0.2mol/0.2L? =" 1" mol/L?(2分)(合理即可得4分,无过程0分)
(4)2.24L?(2分无单位0分)?(5) 0.5 mol/L (3分无单位0分)
本题解析:考查根据方程式及有关物质的量的计算。
(1)铁的相对原子质量是56,所以根据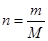 可知,n=5.6g÷56g/mol=1.0mol。
可知,n=5.6g÷56g/mol=1.0mol。
(2)铁是活泼的金属,能和盐酸反应置换出氢气,离子方程式为Fe + 2H+ = H2# + Fe2+。
(3) Fe? +? 2HCl =? H2# +? FeCl2
1? 2? 1
0.1mol? 0.2mol? 0.1mol?
c(HCl) = 0.2mol/0.2L? =" 1" mol/L?
(4)根据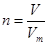 可知,氢气的体积是V=0.1mol×22.4L/mol=2.24L。
可知,氢气的体积是V=0.1mol×22.4L/mol=2.24L。
(5)如果把盐酸改为稀硫酸,则稀硫酸的物质的量是0.1mol,浓度是c(H2SO4) = 0.1mol/0.2L? =" 0.5" mol/L 。
本题难度:一般
5、选择题 有一瓶14%的KOH溶液,加热蒸发掉100 g水后,变为28%的KOH溶液80 mL,该80 mL溶液的物质的量浓度为( )
A.5 mol·L-1
B.6 mol·L-1
C.6.25 mol·L-1
D.6.75 mol·L-1