1、选择题 X、Y、Z三种元素的核电荷数在1~20之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.元素的得电子能力:X<Y<Z
B.气态氢化物的稳定性:按X、Y、Z顺序变大
C.含氧酸的酸性:H3ZO4>H2YO4>HXO4
D.元素负化合价的绝对值:按X、Y、Z顺序变大
参考答案:三种元素的核电荷数在1~20之间,根据它们的最高价氧化物对应的水化物可知化合价分别为X为+7价,Y为+6价,Z为+6价,分别为Cl、S、P元素,则
A.同周期元素从左到右元素的非金属性逐渐增强,则元素的得电子能力:X>Y>Z,故A错误;
B.元素的非金属性:X>Y>Z,非金属性越强,对应的氢化物越稳定,按X、Y、Z顺序变小,故B错误;
C.非金属性越强,对应的最高价氧化物的水化物酸性越强,则含氧酸的酸性:H3ZO4<H2YO4<HXO4,故C错误;
D.根据它们的最高价氧化物对应的水化物可知化合价分别为X为+7价,Y为+6价,Z为+6价,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 0.02 mol某金属单质与足量的盐酸反应,放出0.672 LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第ⅡA族
B.第三周期第ⅢA族
C.第二周期第ⅢA族
D.第四周期第ⅡA族
参考答案:B
本题解析:试题分析:0.672L标准状况下氢气的物质的量是0.672L÷22.4L/mol=0.03mol,转移电子的物质的量是0.03mol×2=0.06mol,这说明该金属在反应中的化合价是0.06÷0.02=3。又因为转变为具有Ne原子的电子层结构的离子,试题该金属元素是Al元素,位于第三周期第ⅢA族,答案选B。
考点:考查元素周期表的结构
点评:该题是高考中的常见题型,属于基础性试题的考查,试题难易适中,基础性强。主要是考查学生对元素周期表结构的熟悉了解程度,特别是灵活运用基础知识解决实际问题的能力,有利于提高学生的学习效率和应试能力。
本题难度:一般
3、选择题 主族元素R的最高正化合价为+2,R元素位于周期表的( )
A.ⅠA族
B.ⅡA族
C.ⅢA族
D.ⅤA族
参考答案:主族元素R的最高正化合价为+2,则最外层电子数为2,由主族元素的族序数=最外层电子数可知,R位于第ⅡA族,
故选B.
本题解析:
本题难度:一般
4、推断题 A、B、C、D为原子序数小于18的四种元素:A原子的电子层数等于最外层电子数;A与B处于同一周期,B与D 可形成离子化合物D2B,该化合物在水溶液中水解显碱性;C的离子核内质子数与核外电子数之和为18;A、C、D 三种元素的离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)写出元素B的元素符号_________,元素B的氢化物的空间构型为__________。
(2)写出D原子形成简单离子的电子排布式________________。
(3)四种元素离子半径的大小顺序为__________,第一电离能最小的是__________。
(4)C的双原子单质分子中含有____个σ键和______个π键,元素C的三原子氢化物中,中心原子C的杂化方式为____________。
(5)元素A和C形成的化合物熔点高,硬度大,工业上常采用电解熔融该化合物的方法来制备单质A。由此 可推断A、C形成的化合物为__________晶体。
参考答案:(1)S;v形(或角形)
(2)1s22s22p6
(3)r(S2-)>r(O2-)>r(Na+)>r(Al3+);Na
(4)1;1;sp3
(5)离子
本题解析:
本题难度:一般
5、填空题 按已知的原子结构规律,82号元素X应是第______周期______族元素,它的最高正价氧化物的化学式为______(该元素的元素符号用X表示).
参考答案:该原子的原子结构示意图为
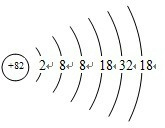
,电子层数=周期数=6,最外层电子数=族序数=4,主族元素的最高化合价数=其最外层电子数=4,所以其最高价氧化物的化学式为:XO2,故答案为:六;ⅣA族;XO2.
本题解析:
本题难度:一般