1、选择题 现有室温下四种溶液,有关叙述不正确的是
编号
| ①
| ②
| ③
| ④
|
pH
| 11
| 11
| 3
| 3
|
溶液
| 氨水
| 氢氧化钠溶液
| 醋酸溶液
| 盐酸
|
?
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③?
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va?L ④溶液与Vb?L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液
pH = 4,则Va?: Vb =" 11" : 9
参考答案:C
本题解析:A、醋酸是弱电解质,盐酸是强电解质,溶液pH=3,则c(CH3COOH)>c(HCl),消耗NaOH物质的量:③>④,正确;B、无论稀释多少倍,酸溶液pH<7,碱溶液pH>7,弱电解质溶液存在电离平衡,稀释时变化小一些,所以pH ①>②>④>③,正确;C、①、④两溶液等体积混合,所得溶液为大量一水合氨与少量氯化铵的混合液,且NH3·H2O电离程度大于NH4Cl的水解程度,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),错误;D、(Va ×10-3- Vb×10-3)/ Va + Vb=10-4,则Va?: Vb =" 11" : 9,正确。
本题难度:一般
2、选择题 现有常温下的四种溶液(如下表),下列有关叙述中正确的是(?)
?
| ①
| ②
| ③
| ④
|
溶液
| 氨水
| 氢氧化钠
| 醋酸
| 盐酸
|
pH
| 11
| 11
| 3
| 3
|
A.温度下降10℃,四种溶液的pH均不变
B.分别加水稀释10倍,四种溶液的pH大小为①>②>④>③
C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D.等体积的③、④两种溶液分别与②反应,恰好中和时,消耗②的体积相等
参考答案:B
本题解析:醋酸和氨水存在电离平衡,降低温度抑制电离,pH是变化的,A不正确。稀释促进电离,所以选项B正确。氯化铵能抑制氨水的电离。但氯化铵也能和氢氧化钠反应,pH减小,C不正确。醋酸的浓度大于盐酸的,所以醋酸消耗的氢氧化钠多,D不正确,答案选D。
本题难度:一般
3、填空题
某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
参考答案:
纯水中 C(OH-) = C(H+) = 2×10-7 mol/L? Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14?稀盐酸中 C(OH-) =" Kw" / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L
本题解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
本题难度:一般
4、选择题 在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线 如图所示,列有关离子浓度的比较正确的是 (?)
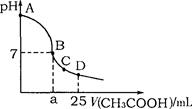
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:A
本题解析:在A、B间任一点(不含A、B点),溶液是碱性的,溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)?;在B点,如果是强酸,a="12.5" 。而醋酸是弱酸,所以a>12.5,且有c(Na+)<c(CH3COO-)?c(OH-)=c(H+)? ; 在C点溶液现酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-);在D点,c(CH3COO-)+c(CH3COOH)>c(Na+),故选A。
点评:强碱和弱酸溶液混合后,溶液中离子浓度的大小比较:
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液;
呈中性: 强碱弱酸盐和少量弱酸的混合溶液;
呈酸性:强碱弱酸盐和大量弱酸的混合溶液。
本题难度:一般
5、填空题 现有浓度均为0.1mol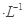 的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(l)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是___________________
_____________________________________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中NH4+浓度由大到小的顺序是_________________(填序号)。
(3)将③和④按体积比l:2混合后,溶液的pH>7,则混合液中各离子浓度由大到小的顺序是________________________________________。
(4)已知t℃时,Kw=1×10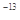 ,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
,则t℃__________(填“>”、“<”或“=”)25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则 a:b=______________。
参考答案:(1)④②③①(2分)
(2)⑥④⑤⑦(2分)
(3)c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)(2分)
(4)>;(2分)? 9:2(2分)
本题解析:(1)④的溶液中盐的水解对水的电离起促进作用,最大;酸碱溶液中对水的电离起抑制作用,但②的H+浓度最小,抑制作用小,①的H+浓度最大,抑制作用最大,所以四种溶液中由水电离出的浓度由大到小的顺序是④②③①;
(2)④中NH4+水解,Cl-不水解,⑤醋酸根离子对NH4+水解起促进作用,⑥硫酸氢铵电离产生的H+对NH4+水解起抑制作用,⑦只是一水合氨的电离产生NH4+,综上所述NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)将③和④按体积比l:2混合后,所得溶液为同浓度的氯化钠、氯化铵、一水合氨的混合液,溶液呈碱性,说明一水合氨的电离大于氯化铵的水解程度,所以混合液中各离子浓度由大到小的顺序是c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+);
(4)Kw是温度常数随温度升高而增大,1×10-13>1×10-14所以t℃>25℃;混合溶液的pH=2说明c(H+)=0.01mol/L,所以c(H+)×b- c(OH-)×a=0.01×(a+b),解得a:b=9:2
本题难度:一般