1、填空题 (8分)将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol;
(2)B的平均反应速率v(B)=________mol/(L·min);
(3)x的值为________。
参考答案:(1)0.75 3 (2)0.05 (3)2
本题解析:C的平均反应速率为0.1 mol/(L·min),所以5min后生成的C是0.5mol/L,又因为同时有0.5 mol/L的D生成,所以根据浓度的变化量之比是相应的化学计量数之比看得出x=2。
3A(g)+B(g) 2C(g)+2D(g)
2C(g)+2D(g)
起始量(mol) y y 0 0
转化量(mol) 1.5 0.5 1.0 1.0
5min后(mol) y-1.5 y-0.5 1.0 1.0
因为c(A)∶c(B)=3∶5,所以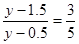 ,解得y=3mol。则此时A的浓度是
,解得y=3mol。则此时A的浓度是
 。B的平均反应速率v(B)=
。B的平均反应速率v(B)=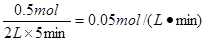 。
。
本题难度:一般
2、选择题 下列叙述正确的是
A.用核磁共振氢谱可以鉴别l一溴丙烷和2一溴丙烷
B.对于可逆反应N2(g)+3H2(g)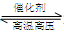 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增大
C.将AlCl3溶液和NaAl02溶液分别蒸干后灼烧,所得固体产物均为Al2O3
D.BaS04在同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同
参考答案:A
本题解析:A:前者有三种氢、后者有两种氢,正确
B:增大氮气浓度只能增加单位体积内活化分子个数,但活化分子百分数并没有改变,不正确
C:所得固体除Al2O3外,还有NaCl,不正确
D:两溶液中硫酸根离子的浓度不同,对沉淀溶解平衡的抑制程度不相等,故BaS04的溶解度不相同,排除
答案为A
本题难度:一般
3、选择题 对于可逆反应:4NH3(g)+5O2(g)
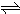
4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2V正(NH3)=3V正(H2O)
B.达到化学平衡时,4V正(O2)=5V逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
参考答案:A、反应速率之比等于化学计量数之比,则3V正(NH3)=2V正(H2O),故A错误;
B、反应达到平衡状态时,正逆反应速率相等,4V正(O2)=5V逆(NO),说明消耗氧气的速率和生成氧气的速率相等,故B正确;
C、达到化学平衡时,若增加容器体积,容器的压强减小,正逆反应速率都减小,故C错误;
D、无论是否达到平衡状态,反应速率之比都等于化学计量数之比,即位时间内生成xmolNO的同时,消耗xmolNH3,但不能说明正逆反应速率相等,故D错误.
故选B.
本题解析:
本题难度:简单
4、选择题 100 mL 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的(? )?
A.Na2SO4(s)
B.CuSO4溶液
C.H2SO4溶液
D.H2O?
参考答案:D
本题解析:略
本题难度:简单
5、选择题 反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是? ( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是? ( )
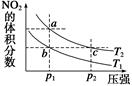
A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.b、c两点的平衡常数:b<c
D.a、c两点气体的平均相对分子质量:a>c
参考答案:C
本题解析:A、对于有气体参加的反应,其他条件不变时,增大体系的压强,反应速率加快,所以a<c,错误;B、因为不确定是采用哪种方式增大压强的,所以颜色深浅不确定,错误;C、正确;D、压强增大,平衡左移,所以a<c,错误。
本题难度:一般