1、选择题 4分)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料(包括硅酸盐材料)、高分子合成材料及复合材料。
⑴生活中的玻璃、陶瓷、水泥属于上述材料中的?,其生产原料不需要使用石灰石的是?。塑料制品给人类生活带来很多方便,但塑料制品造成的“白色污染”已成为社会的一大公害,请你提出一项防治“白色污染”的有效措施:?。
⑵金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳构成许多微小的?,发生电化学腐蚀。
参考答案:⑴无机非金属材料?陶瓷?开发研制降解塑料
⑵原电池(每空1分,共4分
本题解析:略
本题难度:简单
2、填空题 (8分)四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| TiCl4
| SiCl4
|
熔点/℃
| -25.0
| -68.8
|
沸点/℃
| 136.4
| 57.6
参考答案:(8分,各2分)
(1)防止Ti3+被Fe3+氧化成TiO2+或者将TiO2+还原成Ti3+
(2)其分散质颗粒直径大小为10-9~10-7m(或1nm—100nm)
(3)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等
(4)蒸馏(或分馏)等方法
本题解析:略
本题难度:一般
3、选择题 接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
①尾气用氨水处理?②污水用石灰乳处理③废渣用来炼铁、制水泥等④将“废热”通过“废热”锅炉产生蒸气发电.
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:分析:依据对废气、废液、废渣和“废热”的利用和处理分析选项的正确性;
解答:①硫酸厂尾气中含有SO2,可用氨水吸收处理;2NH3+H2O+SO2=(NH4)2SO3,或NH3+H2O+SO2=NH4HSO3;故①正确;
②硫酸厂废水中含有H2SO4,可用石灰乳中和;Ca(OH)2+H2SO4═CaSO4+2H2O;故②正确;
③硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁;废物利用,故③正确;
④由于硫酸生产过程中三个化学反应都是放热反应,可以充分利用这些反应放出的热能来降低生产成本;故④正确;
综上所述,答案为D;
故选D.
点评:本题考查了对废气、废液、废渣和“废热”的处理,处理的目的和应用,熟练掌握工业制备的流程,尾气的处理原则,除杂的分析应用是解题关键.
本题难度:一般
4、填空题 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4·nH2O)。
(1)在常温常压下,“可燃冰”会发生分解反应,其化学方程式是?。
(2)甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油。
①在101 KPa时,1.6 g CH4(g)与H2O(g)反应生成CO、H2,吸热20.64 kJ。则甲烷与H2O(g)反应的热化学方程式:?。
②CH4不完全燃烧也可制得合成气:CH4(g)+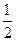 O2(g)===CO(g)+2H2(g); O2(g)===CO(g)+2H2(g);
△H="-35.4" kJ·mol-1。则从原料选择和能源利用角度,比较方法①和②,合成甲醇的适宜方法为(填序号);原因是?。
③在温度为T,体积为10L的密闭容器中,加入1 mol CO、2 mol H2,发生反应
CO(g)+ 2H2(g)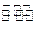 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
I.H2的转化率为?;
II.在相同条件下,若起始时向密闭容器中加入a mol CH3 OH(g),反应平衡后吸收热量Q2 kJ,且Q1+Q2=Q,则a=?mol。
III.已知起始到平衡后的CO浓度与时间的变化关系如右图所示。则t1时将体积变为5L后,平衡向?反应方向移动(填“正”或“逆”);
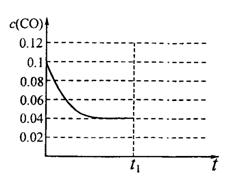 ? ?
在上图中画出从tl开始到再次达到平衡后,
CO浓度与时间的变化趋势曲线。
(3)将CH4设计成燃料电池,其利用率更高,装置示意如右图(A、B为多孔性碳棒)。
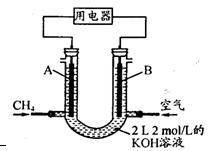
持续通人甲烷,在标准状况下,消耗甲烷体积VL。
①O<V≤44.8 L时,电池总反应方程式为?;
②44.8 L<V≤89.6 L时,负极电极反应为?;
③V=67.2 L时,溶液中离子浓度大小关系为?;
参考答案:
本题解析:略
本题难度:一般
5、选择题 1951年有人从煤矿的坑水中分离出了一种氧化铁硫杆菌。它能促使促使黄铁矿(FeS2)氧化成硫酸铁和硫酸。后来又发现了能把矿物中的硫或硫化物氧化成硫酸的氧化硫杆菌。而硫酸和硫酸铁能将某些矿石中金属元素转化成相应金属的的硫酸盐。从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图:其中a过程发生的反应为:4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4。 2Fe2(SO4)3+2H2SO4。
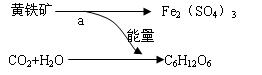
则下列说法不正确的是
A.a过程是释放能量的过程
B.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
C.细菌在反应a过程中起了催化剂的作用
D.有些细菌可以直接把含重金属的矿石溶解,得到含重金属离子的溶液
参考答案:D
本题解析:黄铁矿在氧化铁硫杆菌的作用下被氧气氧化为硫酸和硫酸铁,氧化铁硫杆菌在该过程中实际起了催化剂的作用;而氧化铁硫杆菌在这个过程中获得了该反应的能量,一部分用来自己的活动,一部分被储存在C6H12O6中;故A、B、C都正确;重金属离子能使蛋白质变性,而细菌正是由蛋白组成,故D项错误。
本题难度:一般
|