1、填空题 回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:

(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式?。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是?。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、?、?、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为?。
温度对GeCl4的水解率产生的影响如图1所示,其原因是?。 为控制最佳的反应温度,实验时可采取的措施为?(填序号)。

A.用冰水混合物? B.49℃水浴? C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因?,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应?。
pH
| 4
| 5
| 6
| 7
| 8
| 9
|
溶解率/%
| 47.60
| 32.53
| 11.19
| 5.27
| 1.96
| 8.85
|
?
参考答案:(15分)(1)Ge2++H2O2+2H+=Ge4++2H2O(2分)
(2)抑制GeCl4水解?温度计?冷凝管(各1分)
(3)GeCl4+ (2+n) H2O = GeO2·nH2O↓+ 4HC1?该水解反应是一个放热反应? C(各2分)
(4)二氧化锗具有两性? GeO2+2OH-?= GeO32-+H2O?(各2分)
本题解析:(1)锗元素由+2升为+4价,则 Ge2+是还原剂,H2O2是氧化剂,氧元素由—1降为—2价,则还原产物为H2O,根据电子、电荷和原子守恒配平,则Ge2++H2O2+2H+=Ge4++2H2O;(2)GeCl4是强酸弱碱盐,在水溶液中能水解,加入浓盐酸能使其水解平衡左移,抑制其水解,防止其变质;蒸馏主要用到的仪器是酒精灯、蒸馏烧瓶、铁架台、温度计、冷凝管、接收器、锥形瓶;(3)GeO2·nH2O是水解产物,设其系数为1,根据锗原子、氯原子、氢原子、氧原子守恒,则该水解反应为GeCl4+ (2+n) H2O = GeO2·nH2O+ 4HC1;读图,升高温度,GeCl4的水解率减小,前者能使平衡向吸热反应方向移动,后者说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应速率是放热反应;读图可知,—12℃时GeCl4的水解率最高,所得产品的产率最大;冰水混合物的温度约为0℃,故A错误;49℃时GeCl4的水解率最小,所得产品的产率最小,故B错误;冰盐水的温度可能为—12℃,故C正确;(4)铝、锗均位于元素周期表中金属与非金属交界线附近,铝是锗左上角相邻元素,则锗的性质与铝相似,由此推断GeO2与Al2O3相似,都是两性氧化物;由于Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-=2AlO2-+H2O,由此可仿写出GeO2+4H+=Ge4++2H2O、GeO2+2OH-=GeO32-+H2O,前者是pH<8时GeO2溶解率增大的主要原因,后者是pH>8时GeO2溶解率增大的主要原因。
本题难度:困难
2、填空题 分子筛具有均匀的微孔结构,分子筛筛分作用见下图。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

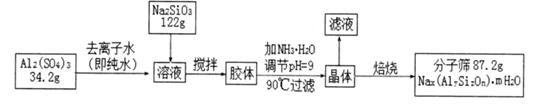
在加NH3·H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10%。
(1)分子筛的孔道直径为4A(1 A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得3A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用?型分子筛。
(2)A12(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为?
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为?;检验其中金属阳离子的操作方法是?
(4)加NH3·H2O调节pH后,加热到90℃并趁热过滤的原因可能是?
(5)该生产流程中所得分子筛的化学式为?
参考答案:(12分)
(1)5A(1分)
(2) 2A13++3SiO32-+ 6H2O=2Al(OH)3+3H2SiO3? (2分)
(3)Na+、NH4+、SO42-(2分)?将铂丝(或铁丝)放在酒精灯外焰上灼烧至无色时,蘸取待测溶液再放在酒精灯外焰上灼烧,若火焰呈黄色,说明待测液中含有Na+(2分)
(4)加热能促进胶体凝聚,趁热过滤可防止其它杂质结晶析出?(2分)
(5)Na(AlSi3O12)·3H2O或 ( Na2O·Al2O3·10SiO2·6H2O)(3分,其它合理答案均给分)
本题解析:该工艺是利用铝离子和硅酸根离子发生双水解反应,得到胶体,然后通过焙烧后得到分子筛。
(1)根据直径大小,4.65A和5.6A,故使用5A分子筛可以分离;
(2)该反应为双水解反应
(3)根据加入物质为Al2(SO4)3、Na2SiO3、NH3·H2O,故Al、Si、Na转化到晶体中,故滤液中有Na+、NH4+、SO42-。检验Na+用焰色反应,检验NH4+用NaOH,再检验NH3;
(5)根据原子利用率及守恒关系可以确定分子式。
本题难度:困难
3、选择题 下列关于硅酸盐工业的叙述正确的是( )
A.普通玻璃的主要成分可以表示为Na2O?CaO?6SiO2,说明玻璃为纯净物
B.陶瓷、玻璃、水泥都属于硅酸盐产品
C.制玻璃、水泥时都用到了石灰石和黏土
D.制玻璃的过程中发生了反应:Na2CO3+SiO2 Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
Na2SiO3+CO2↑,说明酸性:H2SiO3>H2CO3
参考答案:B
本题解析:
本题难度:简单
4、填空题 (10分)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
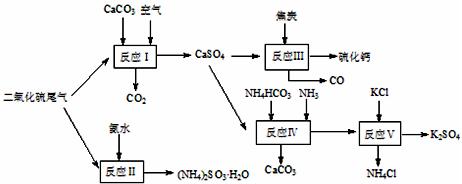
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是? ▲?。
中加入适量的对苯二酚等物质,其目的是? ▲?。
(2)下列有关说法正确的是? ▲?。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C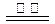 CaS +4CO↑
CaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥