1、选择题 用电解法提取氯化铜废液中的铜,方案正确的是(?)
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化铜溶液吸收阴极产物
D.用带火星的木条检验阳极产物
2、简答题 二甲醚(CH3OCH3)是一种重要的清洁燃料气,其储运、燃烧安全性、理论燃烧温度等性能指标均优于液化石油气,也可用作燃烧电池的燃料,具有很好的好展前景。
(1)已知H2、CO和CH3OCH3的燃烧热(ΔH)分别为-285.5kJ/mol、-283kJ/mol和-1460.0 kJ/mol,则工业上利用水煤气成分按1:1合成二甲醚的热化学方程式为:?。
(2)工业上采用电浮远凝聚法处理污水时,保持污水的pH在5.0,通过电解生成Fe(OH)3胶体,吸附不溶性杂质,同时利用阴极产生的H2,将悬浮物带到水面,利于除去。实验室以二甲醚燃料电池模拟该方法设计的装置如下图所示:

①乙装置以熔融碳酸盐为电解质,稀土金属材料为电极。写出该燃料电池的正极电极反应式?;下列物质可用做电池熔融碳酸盐的是?。
A.MgCO3? B.Na2CO3? C.NaHCO3? D.(NH4)2CO3
②写出甲装置中阳极产物离子生成Fe(OH)3沉淀的离子方程式?。
③已知常温下Ksp[Fe(OH)3]=4.0×10-38,电解一段时间后,甲装置中c(Fe3+)=?。
④已知:H2S的电离平衡常数:K1=9.1×10-8、K2=1.1×10-12;H2CO3的电离平衡常数:K1=4.31×10-7、K2=5.61×10-11。测得电极上转移电子为0.24mol时,将乙装置中生成的CO2通入200mL 0.2mol/L的Na2S溶液中,下列选项正确的是
A.发生反应的离子方程式为:CO2+S2-+H2O=CO32-+H2S
B.发生反应的离子方程式为:CO2+S2-+H2O=HCO3-+HS-
C.c(Na+)=2[c(H2S)+c(HS-)+c(S2-)]
D.c(Na+)+c(H+)=2c(CO32-)+2c(S2-)+c(OH-)
E.c(Na+)>c(HCO3-)>c(HS-)>c(OH-)
3、填空题 (15分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H= ?574 kJ·mol?l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H= ?1160 kJ·mol?l
③H2O(l)=H2O(g) △H=+44kJ·mol?l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式___。
II、开发新能源和三废处理都是可持续发展的重要方面。CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
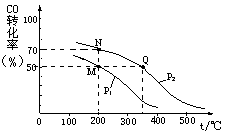
(1)M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2 (填“>” 或“<” 或“=”)
III、用MnO2制KMnO4的工艺流程如下图:电解池中两极材料均为碳棒,在中性或酸性溶液中K2MnO4发生歧化反应而变成MnO2和KMnO4。
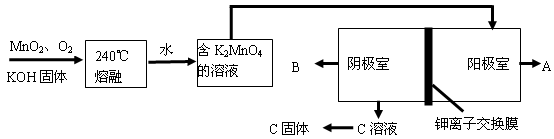
(1)写出240℃熔融时发生反应的化学方程式 ;投料时必须满足n(KOH):n(MnO2) 。
(2)阳极的电极反应式为 。
(3)B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
4、简答题 (20分) Ⅰ.(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,该反应的化学方程式为 ;
生成0.1molK2FeO4转移的电子的物质的量 mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时电池的负极反应式为 。充电时电解液的pH (填“增大”“不变”或“减小”)。
Ⅱ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:

(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH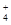 ) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH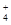 )。
)。
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②20℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH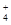 )-3c(Al3+)= mol·L-1。
)-3c(Al3+)= mol·L-1。
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
(4)已知Al(OH)3为难溶物(常温下,Ksp[Al(OH)3]=2.0×10-33)。当溶液pH=5时,某溶液中的
Al3+ (填“能”或“不能”)完全沉淀(溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全)。
5、选择题 高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是?

A铁是阳极,电极反应为Fe-6e一+4H2O=FeO42-+ 8H+
B电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C若隔膜为阴离子交换膜,则OH-自右向左移动
D电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)