1、实验题 工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水。某同学想在实验室探究Cl2性质
并模拟制备漂水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。

(1)配制物质的量浓度为0.375 mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和 。
(2)浓硫酸的作用是 。
(3)装置E中发生化学反应的离子方程式为 。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl2
中HCl气体的原理(用离子方程式表示和文字说明) 。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,
可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因 ;
如需改进,请简述设计方案 (若认为合理。则此问可不答)。
2、实验题 某同学为了研究晶体的性质做如下的实验:
(1)在一烧杯中加入一定量的水,加入硫酸铜,配成饱和溶液
(2)再加入一定量的硫酸铜
(3)取一小的硫酸铜晶体,去除晶体的一小角
(4)用头发系住晶体,把另一头系在一玻璃棒上,并悬在烧杯口,晶体浸没在溶液中
(5)过一夜后,取出发现小晶体长大、规则。
请回答下列问题
(1)为什么要加过量的硫酸铜?如果不过量,现象又如何?___________________________________________________
(2)小晶体长大、规则说明什么?____________________________________________
3、实验题
|
填空回答:
某同学为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验
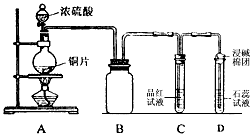
(1)B是用来收集实验中生成的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)请写出铜跟浓硫酸反应的化学方程式:_______________________________。
(3)实验中, C中的现象为________________,这是因为__________________;D中的现象为_________,这是因为________________;A中的溶液将由无色变为_________色。
(4)实验中,该同学取6.4g铜片和12mL 18mol/L H2SO4溶液(浓)放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余;该同学根据所学的化学知识判断还会有一定量H2SO4的剩余,这个判断是正确的。
A.为什么会有一定量H2SO4的剩余?________________________。
B. 下列药品中能够用来验证反应停止后的烧瓶中确有剩余的H2SO4的是_____________(填字母编号)
a.BaCl2溶液 b.Ba(NO3)2溶液 c.银粉 d.Na2CO3粉末
C.为测定所余的H2SO4物质的量,取出了剩余的铜片,洗涤、干燥后称量为mg,则可通过计算得到:
剩余的H2SO4的物质的量=_____________mol。
(5)若将16g铜与50mL H2SO4的物质的量浓度为一定值的浓硫酸反应,铜完全溶解。请回答:
① 反应中产生的气体在标准状况下的体积为____________L。
② 该反应中被还原的H2SO4的物质的量为______________mol。
③ 待产生的气体全部释放后,向溶液中滴加VmL a mol/L NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原浓硫酸中H2SO4的物质的量浓度=_____________mol/L。
4、实验题 (共22分)某实验小组用下列装置进行如下的实验。?
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
?、?。
实验小组在不断鼓入空气的情况下,熄灭酒精灯,发现反应仍能继续进行,说明该反应是? ? ?反应。
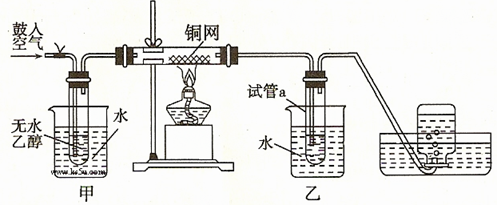
(2)甲和乙两个水浴作用不相同。甲的作用是?;
乙的作用是?。
(3)反应进行一段时间后,干燥的試管a中能收集到不同的物质,那么收集到的有机物是(请填写其结构简式)?;集气瓶中收集到的气体的最主要成分是?。(填写气体的分子式)
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,实验小组的同学认为这可能是存在副产物乙酸。除去该物质,可以使用厨房中常见的一种化合物,该物质为? 。(填写化学式或分子式)
。(填写化学式或分子式)
(5)请写出以上实验涉及的有机物乙醇在生活生产中的一种具体应用:?。
(6)该实验的目的是:?
5、实验题 乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+?2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
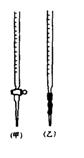
⑴ 滴定时,将KMnO4标准液装在右图中的?(填“甲”或“乙”)滴定管中。
⑵ 本实验滴定达到终点的标志可以是?。
⑶ 通过上述数据,计算出x=?。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会?(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会?。