1、选择题 工业上采用NH3作还原剂脱氮原理为:
NO(g)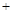 NO2(g)
NO2(g)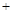 2NH3(g)
2NH3(g)  ?2N2(g)
?2N2(g)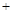 3H2O(g),
3H2O(g),
烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析正确的是
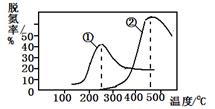
A.上述反应的正反应为吸热反应
B.催化剂①、②分别适合于250℃和450 ℃左右脱氮
C.曲线①、②最高点表示此时平衡转化率最高
D.相同条件下,改变压强对脱氮率没有影响
参考答案:B
本题解析:由于反应为:NO(g) + NO2(g) + 2NH3(g)  ?2N2(g) + 3H2O(g),由图像可知,相同条件下,开始时随温度的升高脱氮率逐渐增大,后随温度的升高脱氮率逐渐减小;最高点表示达到平衡状态,平衡后再升高温度脱氮率反而是减小的,所以,该反应的正反应方向为放热反应,A错;该反应为非等体积反应,压强的改变必须会影响脱氮率,所以D错;曲线①、②最高点表示反应达到平衡状态,C错;由图形分析可知催化剂①、②分别适合于250℃和450℃左右脱氮,B正确;
?2N2(g) + 3H2O(g),由图像可知,相同条件下,开始时随温度的升高脱氮率逐渐增大,后随温度的升高脱氮率逐渐减小;最高点表示达到平衡状态,平衡后再升高温度脱氮率反而是减小的,所以,该反应的正反应方向为放热反应,A错;该反应为非等体积反应,压强的改变必须会影响脱氮率,所以D错;曲线①、②最高点表示反应达到平衡状态,C错;由图形分析可知催化剂①、②分别适合于250℃和450℃左右脱氮,B正确;
本题难度:简单
2、选择题 由金红石(TiO2)制取单质Ti,涉及到的部分步骤为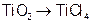
 Ti
Ti
已知:① ? ?
? ? ?②
?②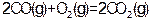 ?
?
③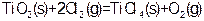 ?
?
则反应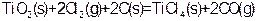 的
的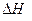 为
为
A. +2
+2 -2
-2
B. +2
+2 +
+
C. +2
+2 -
-
D. +2
+2 -2
-2
参考答案:C
本题解析:略
本题难度:一般
3、填空题 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
T/℃
| 30
| 40
| 50
|
生成NH3量/(10-6 mol)
| 4.8
| 5.9
| 6.0
|
?
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。

(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
参考答案:(1)1.5×10-6
(2)N2(g)+3H2O(l)=2NH3(g)+O2(g)ΔH=+765.2 kJ·mol-1
(3)升高温度
(4)①400 ②<
本题解析:(4)①K=?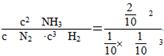 =400。
=400。
②当加入2 mol N2和4 mol H2时,生成2 mol NH3,放出92.4 kJ的热量,而当加入a mol N2、b mol H2和c mol NH3时,平衡时NH3仍为2 mol,则生成的NH3为(2-c) mol,则放出的热量小于92.4 kJ。
本题难度:一般
4、选择题 下列图象分别表示有关反应的反应过程与能量变化的关系:
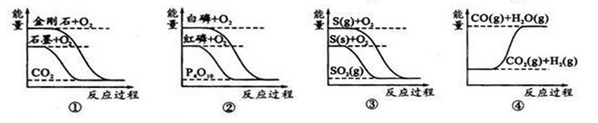
据此判断下列说法正确的是
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.CO(g)+H2O(g)=CO2(g)+H2(g)ΔH>0
D.S(g)+O2(g)=SO2(g) ΔH1; S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
参考答案:A
本题解析:A、石墨的能量比金刚石的低,要想转变为金刚石,必须从外界吸收能量,正确;B、从图中可以看出,红磷的能量比白磷的低,能量越低,越稳定,错误;C、一氧化碳与水反应生成二氧化碳和氢气的反应是一个放热的反应,ΔH<0,错误;D、∣ΔH1∣>∣ΔH2∣,但是ΔH1<ΔH2?错误。
本题难度:一般
5、选择题 对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是(? )
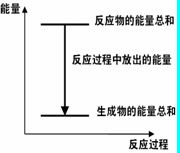
A.反应过程中能量关系可用右图表示
B.若将该反应设计成原电池锌为负极
C.ΔH的值与反应方程式的计量系数无关
D.若将其设计为原电池当有32.5g锌溶解时,