1、选择题 下列说法正确的是(? )
A.放热反应不需加热就能发生
B.1mol可燃物燃烧生成氧化物放出的热量就是该物质的燃烧热
C.反应物总能量大于生成物总能量的反应是放热反应
D.强电解质溶液的导电能力比弱电解质溶液的导电能力强
参考答案:C
本题解析:A 错误,有的放热反应需要加热才能进行,例如:煤的燃烧
B 错误,一定生成稳定的氧化物
C 正确。
D 错误,强、弱电解质是电离程度,全部电离是强电解质,部分电离是弱电解质,而导电能力与溶液中离子浓度大小有关,和强、弱电解质无关。
本题难度:一般
2、选择题 碘与氢气反应的热化学方程式是
①I2(g) + H2(g)  2HI(g) ΔH =-9.48 kJ·mol-1
2HI(g) ΔH =-9.48 kJ·mol-1
②I2(s) + H2(g)  2HI(g) ΔH =" +26.48" kJ·mol-1
2HI(g) ΔH =" +26.48" kJ·mol-1
下列说法正确的是(?)
A.①的产物比②的产物稳定
B.I2(s) = I2(g) ΔH=" +17.00" kJ·mol-1
C.②的反应物总能量比①的反应物总能量低
D.1mol I2(g)中通入1 mol H2(g),发生反应时放热9.48 kJ
参考答案:C
本题解析:①的产物和②的产物都是HI,稳定性相同,A不正确;关键盖斯定律可知,②-①即得到I2(s)=I2(g),则ΔH=26.48kJ/mol+9.48kJ/mol=+35.96kJ/mol,选项B不正确;固体碘的能量低于气态的的能量,所以②的反应物总能量比①的反应物总能量低,C正确;该反应是可逆反应,则1mol I2(g)中通入1 mol H2(g),发生反应时放热一定小于9.48kJ,D不正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生对反应热含义以及利用盖斯定律计算反应热的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力和学习效率。
本题难度:简单
3、选择题 有关下列能量转化的认识不正确的是
[? ]
A.植物的光合作用使得太阳能转化为了化学能
B.人类使用照明设备是将电能转化为了光能
C.生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效
D.燃料燃烧时只是将化学能转化为了热能
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知热化学方程式:2SO2(g)+O2(g) 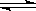 ?2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
?2SO3(g);ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2 mol SO2(g)被氧化
参考答案:D
本题解析:A 错误,此反应是放热反应,2 mol SO2(g)和1 mol O2(g)所具有的能量大于2 mol SO3(g)所具有的能量
B 错误,此反应是可逆反应,2 mol SO2(g)和1 mol O2(g)未反应彻底,放出热量小于Q kJ
C 错误,增大压强平衡右移
D 正确,当反应放热Q kJ时,肯定有2mol SO2(g)参加反应,即被氧化。
本题难度:一般
5、选择题 下列反应属于放热反应的是(?)
A.Ba(OH)2·8H2O与NH4Cl反应
B.碳酸钙受热分解
C.C与CO2在高温下反应
D.H2与Cl2燃烧反应
参考答案:D
本题解析:考查常见的放热反应。一般化合反应是放热反应,金属和水或酸的反应是化合反应,中和反应是放热反应,物质的燃烧是放热反应。所以正确的答案是D。
本题难度:简单