1、选择题 下列说法正确的是
A.金属键是晶体中的阳离子和自由电子之间的吸引力
B.Na2O,MgO,Al2O3的熔点由低到高的顺序为Na2O < MgO < Al2O3
C.HF、H2O、NH3比同族元素形成的氢化物的熔沸点高,因为它们分子间存在叫氢键的化学键
D.CH4、CCl4、CH3Cl、NH4+、P4都是正四面体结构
参考答案:B
本题解析:B.正确。
A.不正确,金属键是晶体中自由电子及排列成晶格状的金属离子之间的静电作用。
B.正确。Na+ Mg2+ Al3+离子半径越来越小,所带电荷越来越多,氧化物的晶格能越来越大,熔点由低到高的顺序为Na2O < MgO < Al2O3;
C.HF、H2O、NH3比同族元素形成的氢化物的熔沸点高,因为它们分子间存在叫氢键的分子间作用力。
D.CH4、CCl4、NH4+、P4都是正四面体结构,CH3Cl不是正四面体结构。
本题难度:一般
2、选择题 关于Na2O2和Na2O下列说法不正确的是?
[? ]
A.Na2O2比稳定Na2O
B.Na2O不能生成Na2O2
C.均属于碱性氧化物?
D.均与CO2反应
参考答案:BC
本题解析:
本题难度:简单
3、填空题 实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是________溶液,乙是_________溶液。
(2)实验②中所发生反应的离子方程式为_____________________________。
(3)甲溶液的物质的量浓度为?,乙溶液的物质的量浓度为__________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是_____________________________。
参考答案:(1)HCl?Na2CO3?
(2)CO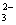 +H+ ="===" HCO
+H+ ="===" HCO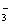 ?HCO
?HCO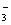 +H+ ="===" CO2↑+H2O
+H+ ="===" CO2↑+H2O
(3)0.8 mol·L-1? 1 mol·L-1
(4)0≤V≤8.96n
本题解析:(1)当向盐酸中加入Na2CO3溶液时,发生反应2H++CO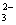 ="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO
="===" CO2↑+H2O,盐酸完全反应后,再加入的Na2CO3不再放出CO2;向Na2CO3溶液中加入盐酸时,先发生反应CO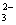 +H+ ="===" HCO
+H+ ="===" HCO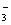 ,当所有CO
,当所有CO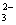 均转化为HCO
均转化为HCO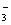 时,再发生反应HCO
时,再发生反应HCO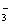 +H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。
+H+ ="===" CO2↑+H2O。由实验①②中数据可知等量的甲与等量的乙反应,实验①产生的CO2气体多,说明甲为HCl、乙为Na2CO3。
(3)设盐酸的物质的量浓度为c(HCl),Na2CO3溶液的物质的量浓度为c(Na2CO3),由实验①得:25.00×10 –3 L·c(HCl) ·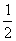 =
=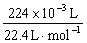 ,c(HCl)="0.8" mol·L-1;
,c(HCl)="0.8" mol·L-1;
由实验②得: 15.00×10-3 L·c(Na2CO3)=25.00×10-3 L×0.8 mol·L-1-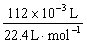 ,
,
c(Na2CO3)="1" mol·L-1。
(4)等体积的甲、乙按实验①的方式进行时产生气体的体积为:
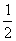 ×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1? =8.96×10-3 nL,若按实验②的方式进行,由反应CO
×n×10-3 L×0.8 mol·L-1×22.4 l·mol-1? =8.96×10-3 nL,若按实验②的方式进行,由反应CO +H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
+H+ ="===" HCO-3可知盐酸不足,不产生气体,故0≤V≤8.96 n。
本题难度:简单
4、选择题 下列金属氧化物中属于两性氧化物的是
[? ]
A.Na2O2
B.Al2O3
C.Fe2O3
D.CaO
参考答案:B
本题解析:
本题难度:简单
5、选择题 有15g Na2O2、Na2O、NaOH的混合物与400 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为
A.23.4 g
B.25.5g
C.31 g
D.无法计算
参考答案:A
本题解析:最终得到的固体是氯化钠,所以根据氯原子守恒可知,氯化钠的物质的量是400×3.65%÷36.5=0.4mol,所以氯化钠的质量是0.4mol×58.5g/mol=23.4g,答案选A。
本题难度:一般